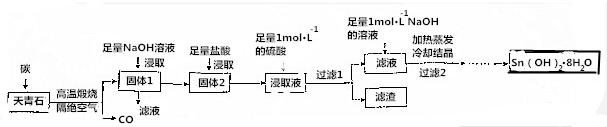
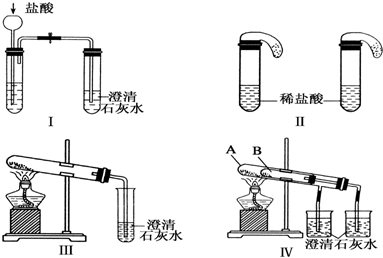
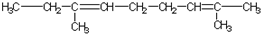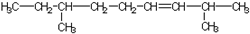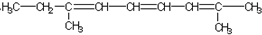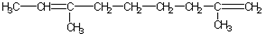题目内容
4.松花蛋,又称皮蛋.其中一种加工工艺的主要原料配方为:将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.请回答下列问题:
(1)生石灰加入沸水中,写出该化学反应的化学方程式CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)取上层清液分析,一定含有的溶质NaOH、NaCl.可能还含有其它溶质,但不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(用化学方程式表示).
(4)你认为可能含有的溶质Na2CO3或Ca(OH)2,并用实验证明.
| 实验步骤 | 实验现象 |
(6)在上述反应过程中,没有涉及到的化学反应类型分解反应、置换反应.
分析 (1)生石灰加入沸水中,生成氢氧化钙,并放出大量的热;
(2)酚酞遇碱溶液变红色;
(3)纯碱与氢氧化钙反应生成NaOH可溶于水,且NaCl溶于水;
(4)若含碳酸钠,与盐酸反应生成气体;若含氢氧化钙,与碳酸钠反应生成白色沉淀;
(5)食醋,可以去除氨味和涩感,在溶液中醋酸与一水合氨反应生成醋酸铵和水;
(6)CaO+H2O=Ca(OH)2为化合反应、Ca(OH)2+Na2CO3=2NaOH+CaCO3↓为复分解反应,以此来解答.
解答 解:(1)生石灰加入沸水中,该化学反应的化学方程式为CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热,
故答案为:CaO+H2O=Ca(OH)2;反应过程放热;
(2)静置后,取少量的上层料液,溶液显碱性,稀释后滴加无色酚酞试液,料液应变为红色,故答案为:红;
(3)纯碱与氢氧化钙反应生成NaOH可溶于水,且NaCl溶于水,则上层清液一定含有的溶质为NaOH、NaCl;不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,
故答案为:NaOH、NaCl;Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
(4)可能含有的溶质为Na2CO3或Ca(OH)2,若含Na2CO3,取少量上层料液,滴加稀盐酸,有气泡产生;若含Ca(OH)2,取少量上层料液,滴加碳酸钠溶液,产生白色沉淀,故答案为:Na2CO3或Ca(OH)2;
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸(或取少量上层料液,滴加碳酸钠溶液) | 有气泡产生(产生白色沉淀) |
(5)在溶液中醋酸与一水合氨反应生成醋酸铵和水,则皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是发生酸碱中和反应,
故答案为:发生酸碱中和反应;
(6)CaO+H2O=Ca(OH)2为化合反应、Ca(OH)2+Na2CO3=2NaOH+CaCO3↓为复分解反应,则上述过程没有涉及分解反应、置换反应,故答案为:分解反应、置换反应.
点评 本题考查物质的组成及含量的确定,为高频考点,把握物质的性质、发生的反应及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
14.在水溶液中能大量共存,加入过量的稀H2SO4后有沉淀和气体产生的组含有的离子是( )
| A. | HCO3-,Cl-,Na+,NH4+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,CO32-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
15.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的说法正确的是( )
| A. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti在周期表中位置相同,都在第4纵行 | |
| C. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的物理性质相同 | |
| D. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
9.下列变化不需要破坏化学键的是( )
| A. | 加热氯化铵 | B. | 干冰气化 | C. | 水通电分解 | D. | 氯化氢溶于水 |
13.下列化学用语表示正确的是( )
| A. | 乙烯的最简式:CH2═CH2 | |
| B. | Cl-的离子结构示意图: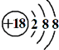 | |
| C. | 二氧化碳的电子式: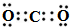 | |
| D. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl |
14.25℃、101kPa 下:
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=-317kJ/mol |