题目内容
18.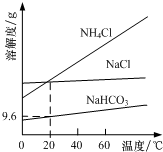 以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )| A. | 将NaHCO3加热分解可得纯碱 | |
| B. | 常温下碳酸氢钠的溶解度大于碳酸钠 | |
| C. | 采用蒸发结晶从溶液中分离出NaHCO3 | |
| D. | 20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L |
分析 A.碳酸氢钠受热分解生成碳酸钠=二氧化碳和水;
B.常温下碳酸氢钠溶解度小于碳酸钠;
C.碳酸氢钠受热分解;
D.20℃时碳酸氢钠溶解度为9.6g,溶质物质的量n=$\frac{m}{M}$,溶液体积近似为100ml计算;
解答 解:A.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,将NaHCO3加热分解可得纯碱,故A正确;
B.Na2CO3+CO2+H2O=2NaHCO3↓,常温下碳酸氢钠溶解度小于碳酸钠,故B错误;
C.碳酸氢钠受热分解,采用蒸发结晶不能从溶液中分离出NaHCO3,故C错误;
D.20℃时碳酸氢钠溶解度为9.6g,溶质物质的量n=$\frac{m}{M}$=$\frac{9.6g}{84g/mol}$=0.114mol,溶液体积近似为100ml计算得到c=$\frac{0.114mol}{0.1L}$=1.1mol/L,故D正确;
故选BC.
点评 本题考查了钠及其化合物性质的分析应用,主要是碳酸钠、碳酸氢钠性质区别,注意溶解度曲线分析和溶质浓度的计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A. | 阳极发生还原反应 | |
| B. | 电解后,电解槽底部的阳极泥中只有Cu和Pt | |
| C. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| D. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
9.下列变化不需要破坏化学键的是( )
| A. | 加热氯化铵 | B. | 干冰气化 | C. | 水通电分解 | D. | 氯化氢溶于水 |
6.下列关于有机物的说法中,不正确的是( )
| A. | 糖类、有脂和蛋白质都能发生水解反应 | |
| B. | 乙烯、氯乙烯均可用于合成塑料 | |
| C. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| D. | 分子式为C6H14的有机物只有5种,它们属于同分异构体 |
13.下列化学用语表示正确的是( )
| A. | 乙烯的最简式:CH2═CH2 | |
| B. | Cl-的离子结构示意图: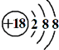 | |
| C. | 二氧化碳的电子式: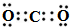 | |
| D. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl |
3.下列关于某些社会热点问题的说法中,错误的是( )
| A. | 甲醛是某些劣质装饰板材释放的常见污染物之一 | |
| B. | 光化学烟雾的产生与人为排放氮氧化物有关 | |
| C. | 臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关 | |
| D. | 禁止使用含铅汽油是为了提高汽油的燃烧效率 |
7.下列描述正确的是( )
| A. | 16O→18O的转化属于化学变化 | |
| B. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 | |
| C. | 冶金厂常用高压电除去烟尘,是因为胶体带电荷 | |
| D. | 少量Cu将足量浓、稀硝酸分别还原为NO2和NO,其转移电子数之比为1:3 |
8.双缩脲法测定禾谷类作物样品中的蛋白质含量时,加入少量的四氯化碳(CCl4)其主要作用是( )
| A. | 促进双缩脲反应 | B. | 消除色素类对比色的干扰 | ||
| C. | 促进难溶性物质沉淀 | D. | 保持反应物颜色的稳定 |
 .
.