题目内容
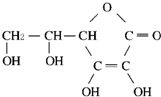 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:由结构简式可知分子式,分子中含碳碳双键、酚-OH、-COOC-,结合烯烃、酚、酯的性质来解答.
解答:
解:A.由结构简式可知,维生素C的分子式为C6H8O4,故A正确;
B.维生素C高温时不稳定,分解后其含量减少,所以生吃蔬菜水果比熟吃维生素C的损失少,故B正确;
C.含碳碳双键,则可发生加成反应,故C正确;
D.维生素C不具有防腐功能,不能在食品中作防腐剂,但可以作营养强化剂,故D错误;
故选D.
B.维生素C高温时不稳定,分解后其含量减少,所以生吃蔬菜水果比熟吃维生素C的损失少,故B正确;
C.含碳碳双键,则可发生加成反应,故C正确;
D.维生素C不具有防腐功能,不能在食品中作防腐剂,但可以作营养强化剂,故D错误;
故选D.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃及化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L酒精含有的分子数为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA |
| C、通常状况下,1 NA个CO2分子含有原子数为3 NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
下列有关化学平衡常数K的说法中,正确的是( )
| A、K的大小与起始浓度有关 |
| B、温度越高,K值越大 |
| C、K值越大,反应物的转化率越大 |
| D、K值越大,正向反应进行的程度越小 |
如图所示可逆反应:mA(g)+nB(g)?xC(g),△H=Q kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是( )


| A、Q>0,m+n>x |
| B、Q>0,m+n<x |
| C、Q<0,m+n<x |
| D、Q<0,m+n>x |
下列甲组、乙组中的两种试剂分别混合,甲组能产生气体,乙组气体会被大量吸收的是( )
| A、甲:过氧化钠和水,乙:浓氨水和SO2 |
| B、甲:浓盐酸和MnO2,乙:BaCl2溶液和SO2 |
| C、甲:冷的浓硫酸和铝,乙:NaOH溶液和Cl2 |
| D、甲:浓硫酸和蔗糖(滴有几滴水),乙:H2SO4溶液和氨气 |
下列叙述正确的是( )
| A、明矾和漂白粉常用于自来水净化和杀菌消毒,其作用原理相同 |
| B、Cl2和SO2的漂白原理不同,混合使用效果更好 |
| C、汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 |
| D、可用浓盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性 |
300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
| A、0.4mol/L |
| B、0.3mol/L |
| C、0.2mol/L |
| D、0.1mol/L |
20世纪末,由中国学者和美国科学家共同合成了世界上最大的碳氢分子,其一个分子由1334个碳原子和1146个氢原子构成.关于此物质,下列说法肯定错误的是( )
| A、属烃类化合物 |
| B、常温下是气态 |
| C、可发生加成反应 |
| D、可发生氧化反应 |