题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L酒精含有的分子数为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA |
| C、通常状况下,1 NA个CO2分子含有原子数为3 NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、酒精标准状况不是气体;
B、依据n=
计算物质的量,结合化学式计算钠离子数;
C、依据n=
计算物质的量,结合分子式计算原子数;
D、溶液体积不知不能计算微粒数;
B、依据n=
| m |
| M |
C、依据n=
| N |
| NA |
D、溶液体积不知不能计算微粒数;
解答:
解:A、酒精标准状况不是气体,22.4L酒精不是1mol,故A错误;
B、依据n=
计算物质的量=
=0.01mol,结合化学式计算含有的Na+离子数为0.02NA,故B错误;
C、依据n=
计算物质的量=1mol,结合分子式计算原子数1mol×3×NA=3 NA,故C正确;
D、溶液体积不知不能计算微粒数,故D错误;
故选C.
B、依据n=
| m |
| M |
| 1.06g |
| 106g/mol |
C、依据n=
| N |
| NA |
D、溶液体积不知不能计算微粒数,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积,质量红色物质的量计算微粒数,注意概念理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
已知某乳制品中富含钙元素,则下列食品中也富含钙元素的是( )
| A、水果 | B、动物肝脏 |
| C、海带 | D、豆类 |
3molCl2和2molCO2相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
下列所示的实验装置中,能达到实验目的是( )
A、 除去Cl2中的HCl |
B、 分离乙醇和乙酸 |
C、 检查装置气密性 |
D、 配制150 mL 0.10 mol?L-1盐酸 |
实验中的下列操作正确的是( )
| A、把试管中取量过多的Na2CO3溶液又倒入试剂瓶中 |
| B、将含有HNO3的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、配制一定物质的量浓度的稀硫酸,浓硫酸溶于水后应冷却至室温才能转移到容量瓶中 |
国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列第IA族为第1列,0族元素为第18列,按这个规定,下列说法不正确的是( )
| A、原子最外层有2个电子的元素,不一定是第2列元素 |
| B、第3~12列元素全为金属 |
| C、第17列元素的原子,其半径越大,越容易失去电子 |
| D、每列元素的单质,从上到下,熔沸点均依次增大 |
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,2.24L SO3(常温下为固体)中所含分子数为0.1NA |
| B、32g氧气和32g臭氧所含原子数均为2NA |
| C、在常温常压下,2.24L NH3所含质子数为10NA |
| D、1mol CO2和1mol CO均含有NA个分子,则所占体积也相同 |
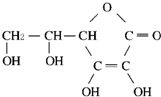 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |