题目内容
如图所示可逆反应:mA(g)+nB(g)?xC(g),△H=Q kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是( )


| A、Q>0,m+n>x |
| B、Q>0,m+n<x |
| C、Q<0,m+n<x |
| D、Q<0,m+n>x |
考点:转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:根据图(1)到达平衡时所用时间的长短判断压强p1和p2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据图(2)判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热.
解答:
解:由图(1)知,p2到达平衡时所用时间长,p1到达平衡时所用时间短,则p2<p1;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x;
图(2)知,随着温度的升高,A的转化率减低,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即△H<0,
所以Q<0,m+n>x.
故选D.
图(2)知,随着温度的升高,A的转化率减低,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即△H<0,
所以Q<0,m+n>x.
故选D.
点评:本题考查化学平衡图象题,题目难度中等,注意温度、压强对反应速率和化学平衡的影响.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
3molCl2和2molCO2相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,2.24L SO3(常温下为固体)中所含分子数为0.1NA |
| B、32g氧气和32g臭氧所含原子数均为2NA |
| C、在常温常压下,2.24L NH3所含质子数为10NA |
| D、1mol CO2和1mol CO均含有NA个分子,则所占体积也相同 |
图中有关电化学的示意图正确的是( )
A、 |
B、 |
C、 |
D、 |
下列溶液中C(Cl-)与50mL 2mol?L-1 MgCl2溶液中C(Cl-)相等的是( )
| A、150 mL 2mol?L-1的NaCl溶液 |
| B、75mL 1mol?L-1的CaCl2溶液 |
| C、200mL 4mol?L-1的KCl溶液 |
| D、50 mL 1mol?L-1的AlCl3溶液 |
下列制备物质的实验能够成功的是( )
| A、将NaF溶液与浓硫酸混合共热制取氟化氢气体 | ||||
B、工业上:H2+Cl2
| ||||
| C、实验室用浓磷酸与溴化钠共热制溴化氢气体 | ||||
| D、实验室用碘化钠与浓硫酸共热制碘化氢气体 |
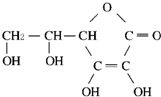 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
在下列各溶液中,离子一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SiO32- |
| C、AlO2-浓度为0.1 mol?L-1的溶液中:Na+、K+、HCO3-、Cl- |
| D、H+浓度为1×10-13mol?L-1的溶液中,Na+、K+、Cl-、NO2- |
下列过程能使蛋白质变性的是K( )
| A、蛋白质中加Na2SO4后析出蛋白质 |
| B、蛋白质用福尔马林浸泡 |
| C、蛋白质中加Pb(Ac)2后析出蛋白质固体 |
| D、蛋白质中遇X光后 |