题目内容
300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
| A、0.4mol/L |
| B、0.3mol/L |
| C、0.2mol/L |
| D、0.1mol/L |
考点:物质的量浓度的相关计算,离子方程式的有关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算n(Al3+),根据电荷守恒可知n(SO42-)=
n(Al3+),根据n=cV计算n(Ba2+),混合溶液中发生离子反应:SO42-+Ba2+═BaSO4↓,计算参加反应的硫酸根的物质的量,进而计算剩余硫酸根的物质的量,再根据c=
计算.
| m |
| M |
| 3 |
| 2 |
| n |
| V |
解答:
解:溶液中Al3+为1.62g,物质的量为
=0.06mol,
根据电荷守恒可知,溶液中n(SO42-)=
n(Al3+)=
×0.06mol=0.09mol,
加入的氢氧化钡的物质的量为:0.1mol/L×0.1L=0.01mol,
SO42-+Ba2+═BaSO4↓
0.01mol 0.01mol
所以硫酸根有剩余,剩余硫酸根的物质的量为0.09mol-0.01mol=0.08mol,
所以反应后溶液中SO42-的物质的量的浓度为
=0.2mol/L,
故选C.
| 1.62g |
| 27g/mol |
根据电荷守恒可知,溶液中n(SO42-)=
| 3 |
| 2 |
| 3 |
| 2 |
加入的氢氧化钡的物质的量为:0.1mol/L×0.1L=0.01mol,
SO42-+Ba2+═BaSO4↓
0.01mol 0.01mol
所以硫酸根有剩余,剩余硫酸根的物质的量为0.09mol-0.01mol=0.08mol,
所以反应后溶液中SO42-的物质的量的浓度为
| 0.08mol |
| 0.3L+0.1L |
故选C.
点评:本题考查离子反应、物质的量浓度计算等,难度不大,铝离子与氢氧根离子反应为干扰反应,与此反应无关,清楚反应过程是关键.

练习册系列答案
相关题目
国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列第IA族为第1列,0族元素为第18列,按这个规定,下列说法不正确的是( )
| A、原子最外层有2个电子的元素,不一定是第2列元素 |
| B、第3~12列元素全为金属 |
| C、第17列元素的原子,其半径越大,越容易失去电子 |
| D、每列元素的单质,从上到下,熔沸点均依次增大 |
下列溶液中C(Cl-)与50mL 2mol?L-1 MgCl2溶液中C(Cl-)相等的是( )
| A、150 mL 2mol?L-1的NaCl溶液 |
| B、75mL 1mol?L-1的CaCl2溶液 |
| C、200mL 4mol?L-1的KCl溶液 |
| D、50 mL 1mol?L-1的AlCl3溶液 |
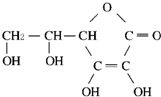 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
下列各组中两种气体的分子数一定相等的是( )
| A、温度相同、体积相同的O2和N2 |
| B、质量相等、密度不等的N2和C2H4 |
| C、体积相同、密度相等的CO和C2H4 |
| D、压强相同,体积相同的O2和H2 |
在下列各溶液中,离子一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SiO32- |
| C、AlO2-浓度为0.1 mol?L-1的溶液中:Na+、K+、HCO3-、Cl- |
| D、H+浓度为1×10-13mol?L-1的溶液中,Na+、K+、Cl-、NO2- |
下列化学实验操作或事故处理方法正确的是( )
| A、实验做完后,直接用嘴吹灭酒精灯 |
| B、浓硫酸沾到皮肤上时,立即用湿抹布冲洗,然后涂上3%~5%的NaOH溶液 |
| C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
下列关于1.0mol?L-1的NaCl溶液的说法正确的是( )
| A、溶液中含有1mol NaCl |
| B、1L溶液中含有58.5g NaCl |
| C、1mol NaCl溶于1L水中 |
| D、58.5g NaCl溶于941.5g水中 |