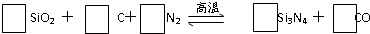题目内容
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.
(1)该温度下的该反应的平衡常数= (用数值表示)
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
①化学平衡将向 方向移动,NO2的转化率将 ;
②经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是 mol/L;
③整个过程中,SO2的转化率由50%变为 %,NO2的转化率由 %变为 %.
④计算结果给我们的启示是:增大一种反应物物的用量,其转化率将 (填“增大”、“不变”或“减小”)另一反应物的转化率将 (填“增大”、“不变”或“减小”).现实生产中的意义是:可以通过增大 的用量,来提高成本较高的反应物的利用率.
(1)该温度下的该反应的平衡常数=
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
①化学平衡将向
②经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是
③整个过程中,SO2的转化率由50%变为
④计算结果给我们的启示是:增大一种反应物物的用量,其转化率将
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到平衡常数;
(2)①加入二氧化硫增大反应物浓度平衡正向进行,两种物质反应增加一种物质会提高另一种物质的转化率;
②依据平衡常数结合化学平衡三段式列式计算;
③依据上述计算依据转化率=
×100%计算分析;
④两种物质反应增加一种物质会提高另一种物质的转化率
(2)①加入二氧化硫增大反应物浓度平衡正向进行,两种物质反应增加一种物质会提高另一种物质的转化率;
②依据平衡常数结合化学平衡三段式列式计算;
③依据上述计算依据转化率=
| 消耗量 |
| 起始量 |
④两种物质反应增加一种物质会提高另一种物质的转化率
解答:
解:在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.
(1)依据平衡三段式列式计算;
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L)0.2×50% 0.2×50% 0.2×50% 0.2×50%
平衡量(mol/L)0.2×50%=0.1 0.2×50%=0.1 0.2×50%=0.1 0.2×50%=0.1
平衡常数K=
=1;
故答案为:1;
(2)①该温度下,SO2(g)+NO2(g)?SO3(g)+NO(g),该容器中,再继续加入1mol的SO2(g),平衡正向进行,二氧化氮转化率增大;
故答案为:正反应,增大;
②依据平衡三段式计算,该容器中,再继续加入1mol的SO2(g),转化二氧化硫物质的量浓度为x
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 0.2+0.1 0.2 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.3-x 0.2-x x x
反应前后气体物质的量不变,可以用物质的量代替平衡浓度计算平衡常数,K=
=1
x=0.12mol/L
当达到新的平衡状态时,容器中SO2(g)的浓度是0.3mol/L-0.12mol/L=0.18mol/L;
故答案为:0.18;
③加入二氧化硫前二氧化硫转化率=二氧化氮转化率=50%,加入1mol二氧化硫后达到平衡状态,二氧化硫转化率=
×100%=40%,二氧化氮转化率=
×100%=60%
整个过程中,SO2的转化率由50%变为40%,NO2的转化率由50%变化为60%;
故答案为:40,50,60;
④分析计算结果可知,两种反应物反应,增加一种物质的量会提高另一种物质的转化率,本身转化率减小,可以利用此规律在现实生产中通过增加廉价反应物的量增加成本较高的反应物的利用率;
故答案为:减小,增大,廉价反应物;
(1)依据平衡三段式列式计算;
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L)0.2×50% 0.2×50% 0.2×50% 0.2×50%
平衡量(mol/L)0.2×50%=0.1 0.2×50%=0.1 0.2×50%=0.1 0.2×50%=0.1
平衡常数K=
| 0.1×0.1 |
| 0.1×0.1 |
故答案为:1;
(2)①该温度下,SO2(g)+NO2(g)?SO3(g)+NO(g),该容器中,再继续加入1mol的SO2(g),平衡正向进行,二氧化氮转化率增大;
故答案为:正反应,增大;
②依据平衡三段式计算,该容器中,再继续加入1mol的SO2(g),转化二氧化硫物质的量浓度为x
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 0.2+0.1 0.2 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.3-x 0.2-x x x
反应前后气体物质的量不变,可以用物质的量代替平衡浓度计算平衡常数,K=
| x2 |
| (0.3-x)(0.2-x) |
x=0.12mol/L
当达到新的平衡状态时,容器中SO2(g)的浓度是0.3mol/L-0.12mol/L=0.18mol/L;
故答案为:0.18;
③加入二氧化硫前二氧化硫转化率=二氧化氮转化率=50%,加入1mol二氧化硫后达到平衡状态,二氧化硫转化率=
| 0.12mol/L |
| 0.3mol/L |
| 0.12mol/L |
| 0.2mol/L |
整个过程中,SO2的转化率由50%变为40%,NO2的转化率由50%变化为60%;
故答案为:40,50,60;
④分析计算结果可知,两种反应物反应,增加一种物质的量会提高另一种物质的转化率,本身转化率减小,可以利用此规律在现实生产中通过增加廉价反应物的量增加成本较高的反应物的利用率;
故答案为:减小,增大,廉价反应物;
点评:本题考查了化学平衡计算应用,主要是平衡常数、转化率分析计算和规律总结,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
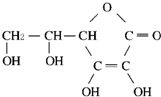 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
下列关于1.0mol?L-1的NaCl溶液的说法正确的是( )
| A、溶液中含有1mol NaCl |
| B、1L溶液中含有58.5g NaCl |
| C、1mol NaCl溶于1L水中 |
| D、58.5g NaCl溶于941.5g水中 |
下列过程能使蛋白质变性的是K( )
| A、蛋白质中加Na2SO4后析出蛋白质 |
| B、蛋白质用福尔马林浸泡 |
| C、蛋白质中加Pb(Ac)2后析出蛋白质固体 |
| D、蛋白质中遇X光后 |