题目内容
下列有关化学平衡常数K的说法中,正确的是( )
| A、K的大小与起始浓度有关 |
| B、温度越高,K值越大 |
| C、K值越大,反应物的转化率越大 |
| D、K值越大,正向反应进行的程度越小 |
考点:化学平衡常数的含义
专题:化学平衡专题
分析:平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,与浓度、压强无关,平衡常数越大,说明可逆反应进行的程度越大,以此解答该题.
解答:
解:A.平衡常数是温度的函数,只与温度有关,对于同一个化学反应来说,在相同温度下,平衡常数为定值,故A错误;
B.温度升高,如平衡向正反应方向移动,则K值增大,如向逆反应方向移动,则K值减小,故B错误;
C.K值越大,说明平衡时生成物浓度越大,反应物浓度越小,则反应物的转化率越大,故C正确;
D.K值越大,反应物的转化率越大,则正向反应进行的程度越大,故D错误.
故选C.
B.温度升高,如平衡向正反应方向移动,则K值增大,如向逆反应方向移动,则K值减小,故B错误;
C.K值越大,说明平衡时生成物浓度越大,反应物浓度越小,则反应物的转化率越大,故C正确;
D.K值越大,反应物的转化率越大,则正向反应进行的程度越大,故D错误.
故选C.
点评:本题考查了化学平衡常数、影响因素及应用,为高频考点,侧重于学生的分析能力的考查,难度不大,注意化学平衡常数只与温度有关,同一转化关系化学计量数不同,平衡常数不同,温度相同,同一可逆反应的正、逆反应平衡常数互为倒数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知某乳制品中富含钙元素,则下列食品中也富含钙元素的是( )
| A、水果 | B、动物肝脏 |
| C、海带 | D、豆类 |
国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列第IA族为第1列,0族元素为第18列,按这个规定,下列说法不正确的是( )
| A、原子最外层有2个电子的元素,不一定是第2列元素 |
| B、第3~12列元素全为金属 |
| C、第17列元素的原子,其半径越大,越容易失去电子 |
| D、每列元素的单质,从上到下,熔沸点均依次增大 |
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,2.24L SO3(常温下为固体)中所含分子数为0.1NA |
| B、32g氧气和32g臭氧所含原子数均为2NA |
| C、在常温常压下,2.24L NH3所含质子数为10NA |
| D、1mol CO2和1mol CO均含有NA个分子,则所占体积也相同 |
下列溶液:①CH3COOH ②HCl ③NaOH ④CH3COONa ⑤KCl ⑥NH4Cl其物质的量浓度均为0.1mol/L,其pH由小到大排列顺序为( )
| A、③④⑤⑥①② |
| B、④⑤⑥①③② |
| C、②①⑥⑤④③ |
| D、②③①⑥⑤④ |
图中有关电化学的示意图正确的是( )
A、 |
B、 |
C、 |
D、 |
下列溶液中C(Cl-)与50mL 2mol?L-1 MgCl2溶液中C(Cl-)相等的是( )
| A、150 mL 2mol?L-1的NaCl溶液 |
| B、75mL 1mol?L-1的CaCl2溶液 |
| C、200mL 4mol?L-1的KCl溶液 |
| D、50 mL 1mol?L-1的AlCl3溶液 |
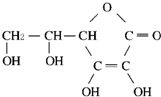 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
下列关于1.0mol?L-1的NaCl溶液的说法正确的是( )
| A、溶液中含有1mol NaCl |
| B、1L溶液中含有58.5g NaCl |
| C、1mol NaCl溶于1L水中 |
| D、58.5g NaCl溶于941.5g水中 |