题目内容
17.利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示: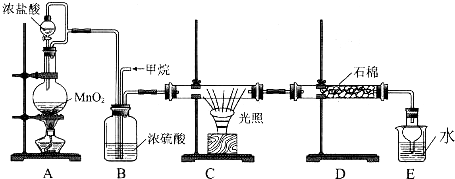
(1)A中制取C12反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)C中发生反应的化学方程式是CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl.(写出一个即可)
(3)D装置中的石棉上吸附着潮湿的KI粉末,其作用是除去过量的氯气.
(4)E装置的作用是C(填序号).
a.收集气体 b.吸收氯气 c.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是分液(填操作名称).
(6)将l mol CH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是2.5mol.
分析 甲烷与氯气在光照的条件下发生取代反应生成多种氯代甲烷和氯化氢.A装置是浓盐酸和二氧化锰制取氯气的发生装置,通过B装置,除去氯气中的水蒸气,控制两种气体的流速,使氯气和甲烷混合均匀,C装置是甲烷和氯气发生取代反应的装置,D装置盛有湿润的KI粉末可以用来除去过量的氯气,尾气中含有有毒气体CH3Cl和过量的甲烷,容易污染空气,需要进行尾气处理.
(1)MnO2能将HCl(浓)氧化为MnCl2和Cl2;
(2)甲烷可以和氯气放生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、三氯甲烷和氯化氢;
(3)氯气具有强氧化性,能将碘离子氧化生成碘单质,所以D装置的石棉中均匀混有KI粉末,其作用是吸收过量的氯气;
(4)尾气中含有有毒气体CH3Cl和过量的甲烷,容易污染空气,需要进行尾气处理;
(5)盐酸和有机物不能互溶,所以可以采用分液的方法分离;
(6)根据四种取代物的物质的量相等结合碳原子守恒计算取代物的物质的量,再根据被取代的氢原子和氯气分子之间的关系式计算消耗氯气的物质的量;
解答 解:甲烷与氯气在光照的条件下发生取代反应生成多种氯代甲烷和氯化氢.A装置是浓盐酸和二氧化锰制取氯气的发生装置,通过B装置,除去氯气中的水蒸气,控制两种气体的流速,使氯气和甲烷混合均匀,C装置是甲烷和氯气发生取代反应的装置,D装置盛有湿润的KI粉末可以用来除去过量的氯气,尾气中含有有毒气体CH3Cl和过量的甲烷,容易污染空气,需要进行尾气处理.
(1)MnO2能将HCl(浓)氧化为MnCl2和Cl2,A中制取Cl2反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)甲烷与氯气反应生成一氯甲烷的方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(3)湿润的KI粉末可以用来除去过量的氯气,发生反应:2KI+Cl2=2KCl+I2,
故答案为:除去过量的氯气;
(4)由于上述过程中产生的氯气和HCl均易导致大气污染,所以E的作用是吸收尾气,HCl极易溶于水易发生倒吸,所以E还可以防止倒吸,
故答案为:C;
(5)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,
故答案为:分液;
(6)1mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种取代物,所以每种取代物的物质的量是0.25mol,甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,所以生成0.25mol一氯甲烷需要氯气0.25mol氯气,生成0.25mol二氯甲烷需要氯气0.5mol,生成0.25mol三氯甲烷需要氯气0.75mol氯气,生成0.25mol四氯化碳需要氯气1mol,所以总共消耗氯气的物质的量=0.25mol+0.5mol+0.75mol+1mol=2.5mol,
故答案为:2.5mol;
点评 本题考查氯气的制备以及甲烷与氯气的取代反应,题目难度中等,本题注意实验的原理,以及甲烷的取代反应中被取代的氢原子和氯气之间的关系.

 阅读快车系列答案
阅读快车系列答案(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
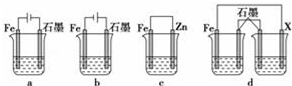
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).
(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定 | |
| D. | 在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 1mol Fe3O4得到6mol电子 | D. | 4molCO失去8mol电子 |
| A. | 可以用四氯化碳把溴水中的溴萃取出来,振荡静置分层后,下层液体为无色 | |
| B. | 萃取分液时,从分液漏斗下口流完下层液体,及时关闭.再打开流出上层液体 | |
| C. | 碘易溶于酒精,微溶于水,故可以用酒精萃取碘水中的碘 | |
| D. | 萃取之后,一般通过分液漏斗将互不相溶的液体分离 |
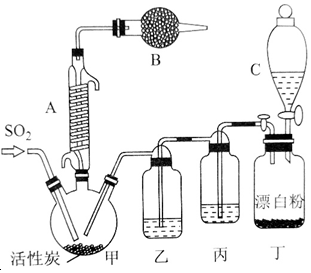 有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解.回答下列问题:
有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解.回答下列问题:
 .
.