题目内容
1. E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:(1)T元素基态原子的最外层电子排布式是3d104s1.
(2)E、G、M三种元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),其原因为同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于氧的.
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为CH4>NH3>H2O(用化学式表示),其中G的最简单氢化物分子的立体构型为正四面体,M的最简单氢化物分子的中心原子的杂化类型为sp3.M和Q的最简单氢化物的沸点大小顺序为H2O>H2S(写化学式).
(4)EM、GM+、G2互为等电子体,EM的结构式为
 (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
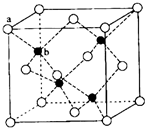
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.(5)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方TQ晶体结构如图所示,该晶体的密度为ρ g•cm-3.如果TQ的摩尔质量为Mg•mol-1,阿伏加德罗常数为NAmol-1,则a、b之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm.
分析 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素;
(1)与T同区、同周期元素为Cu元素,其原子核外有29个电子,3d、4s能级电子为其价电子,根据构造原理书写该原子价电子排布式;
(2)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于同周期相邻元素的;
(3)E、G、M的最简单氢化物分别CH4、NH3、H2O,根据孤对电子之间排斥力>孤对电子与成键电子对之间排斥力>成键电子对之间排斥力,可以判断键角大小;氨气分子为三角锥形;水分子中O原子价层电子对个数是4,杂化轨道数目为4;水分子之间存在氢键,而硫化氢分子之间为范德华力,水的沸点较高;
(4)CO、NO+、N2互为等电子体,等电子体结构相似;
C、O电负性相差1.0,由此可以判断CO应该为极性较强的分子,但实际上CO分子的极性极弱,根据电子对的偏向分析解答;
(5)ZnS晶体结构如图所示,该晶胞中黑色球个数是4、白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{4M}{{N}_{A}}$g,根据V=$\frac{m}{ρ}$计算晶胞体积,再计算晶胞棱长,ab之间距离为该晶胞体对角线长的$\frac{1}{4}$.
解答 解:E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素;
(1)与T同区、同周期元素为Cu元素,其原子核外有29个电子,3d、4s能级电子为其价电子,根据构造原理书写该原子价电子排布式为3d104s1,故答案为:3d104s1;
(2)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于氧的,故第一电离能:N>O>C,
故答案为:N>O>C;同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于氧的;
(3)E、G、M的最简单氢化物分别CH4、NH3、H2O,甲烷中碳原子没有孤对电子,氨气中N原子有1对孤对电子,水分子中O原子有2对孤对电子,孤对电子之间排斥力>孤对电子与成键电子对之间排斥力>成键电子对之间排斥力,故键角大小顺序是CH4>NH3>H2O;氨气分子为三角锥形,水分子中O原子价层电子对个数是4采取sp3杂化,水分子之间存在氢键,而硫化氢分子之间为范德华力,故沸点H2O>H2S,
故答案为:CH4>NH3>H2O;三角锥形;sp3;H2O>H2S;
(4)CO、NO+、N2互为等电子体,等电子体结构相似,则CO分子结构式为 ;
;
C、O电负性相差1.0,由此可以判断CO应该为极性较强的分子,但实际上CO分子的极性极弱,从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性,
故答案为: ;从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
;从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
(5)ZnS晶体结构如图所示,该晶胞中黑色球个数是4、白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{4M}{{N}_{A}}$g,则晶胞V=$\frac{4M}{{N}_{A}}$g÷ρg/cm3=$\frac{4M}{ρ{N}_{A}}$cm3,则晶胞棱长为$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm,ab之间距离为该晶胞体对角线长的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、分子空间构型判断、原子核外电子排布等知识点,难点是晶胞计算中ab距离与晶胞体对角线长关系,需要学生具备一定的空间想象与数学计算能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 若1molSO2和1molO2充分反应,转移的电子数为2×6.02×1023 | |
| B. | 在钢铁表面涂刷含铝粉的防锈漆,可以有效防止钢铁腐蚀 | |
| C. | 在室温下,向醋酸溶液中不断通入NH3,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$不断减小 | |
| D. | 室温下,反应Cl2(g)+H2O(l)═HCl(aq)+HClO(aq) 能自发进行,则△H>0 |
①NaOH ②NaHCO3③Al④苯⑤Na2SO4⑥NH3⑦HCl⑧甲烷.
| A. | ①②⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ①④⑤⑥⑦ | D. | ①②⑥⑦⑧ |
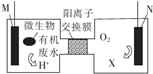 为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+ | |
| C. | 物质X是OH- | |
| D. | 该装置工作时,H+从右侧经阳离子交换膜转向左侧 |
| A. | 二氯甲烷只有一种,说明甲烷分子是立体结构 | |
| B. | 2-丁烯四个碳原子共平面,说明乙烯分子是平面结构 | |
| C. | 苯乙炔分子中所有原子共平面,说明乙炔分子中原子在一条直线上 | |
| D. | 邻二甲苯只有一种,说明苯分子中不存在单双键交替的碳碳键. |
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 100mL 18.4mo1•L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | 标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA | |
| D. | 用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.3NA |
| A. | 羟基的电子式 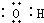 | B. | 丙烯的球棍模型 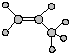 | ||
| C. | 乙炔的电子式  | D. | 乙酸的实验式 C2H4O2 |