题目内容
9.下列能与氨基酸反应的是( )①NaOH ②NaHCO3③Al④苯⑤Na2SO4⑥NH3⑦HCl⑧甲烷.
| A. | ①②⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ①④⑤⑥⑦ | D. | ①②⑥⑦⑧ |
分析 氨基酸的官能团为-NH2和-COOH,-NH2显碱性,能和酸反应;-COOH显酸性,能和活泼金属、碱、弱酸盐、氨气等反应,据此分析.
解答 解:氨基酸的官能团为-NH2和-COOH,-NH2显碱性,能和酸反应,故能与⑦反应;-COOH显酸性,能和活泼金属、碱、弱酸盐、氨气等反应,故能和①②③⑥反应,故选B.
点评 本题考查了氨基酸的性质,难度不大,应注意的是氨基酸是两性化合物.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
2.有机化合物Y可以由X合成: ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 化合物Y中含有1个手性碳原子 | |
| B. | 用FeCl3溶液可鉴别化合物X和Y | |
| C. | 1molX与溴水反应最多消耗1molBr2 | |
| D. | 在一定条件,化合物X、Y均可以发生缩聚反应和加聚反应 |
3.X、Y、Z、R、W均为前四周期的主族元素,其位置关系如图所示.下列说法正确的是( )
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | X的氢化物沸点一定比Z的氢化物沸点高 |
17.实验室以绿矾(FeSO4•7H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2 CH2COO)2 Fe〕.有关物质性质:
实验过程:
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
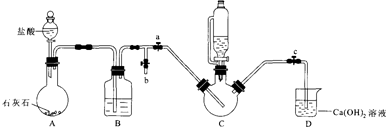
回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如表:
pH过低使产率下降的原因是H+会与NH2CH2COOH反应;柠檬酸的作用还有bc(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$×100%.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$×100%.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
4.对烷烃CH3CH(C2H5)CH(CH3)2的命名,正确的是( )
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
14.设NA阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 19gNHD2和19gNH2T中含有的中子数均为9NA | |
| B. | 1molCnH2n+2中含有的共用电子对数为(3n+1)NA | |
| C. | 2 mol Na2O2有的阴离子数为4NA | |
| D. | 2 mol SO2和1 molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
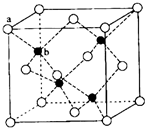 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.