题目内容
16.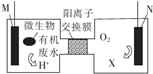 为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+ | |
| C. | 物质X是OH- | |
| D. | 该装置工作时,H+从右侧经阳离子交换膜转向左侧 |
分析 由题意利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,即为原电池,由图N极通O2,M极为有机物,则N极为正极发生还原反应,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+,原电池中阳离子移向正极;
解答 由题意利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,即为原电池,由图N极通O2,M极为有机物,则N极为正极发生还原反应,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+,原电池中阳离子移向正极;
A.由图N极通O2,则N极为正极,故A错误;
B.M极为有机物,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+,故B正确;
C.由图N极通O2,则N极为正极,O2得电子结合H+生成水,物质X为水,故C错误;
D.原电池中阳离子移向正极,该装置工作时,H+从左侧经阳离子交换膜转向右侧,故D错误.
故选B.
点评 本题考查原电池基本原理,侧重考查学生获取信息、分析推断能力,根据化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
9.室温时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=7的溶液中:Ba2+、K+、CO32-、NO3- | |
| B. | 0.1 mol•L-1NaHCO3溶液中:K+、NH4+、Cl-、SO42- | |
| C. | 0.1 mol•L-1FeCl3溶液中:Al3+、Cu2+、Br-、I- | |
| D. | 由水电离产生的c(H+)=1×10-13的溶液中:Na+、Mg2+、Cl-、HCO3- |
4.对烷烃CH3CH(C2H5)CH(CH3)2的命名,正确的是( )
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
11. 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
装置B中发生的反应为C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
合成反应:
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀得到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分转入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,试管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验时没有装置D c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.装置B中发生的反应为C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀得到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分转入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,试管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验时没有装置D c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
8.下列各选项有机物数目,与分子式为ClC4H7O2 且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯( 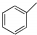 )的一氯代物 )的一氯代物 | D. | 立体烷 (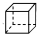 )的二氯代物 )的二氯代物 |
5.如表元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍.下列说法中不正确的是( )
| X | |||
| Y | Z | W | A |
| T | B |
| A. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| B. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
6.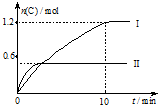 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
实验内容和结果分别如下表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如下表和如图所示.下列说法正确的是( )
| 实验序号 | 温度 | 起始物质的量 | |
| A | B | ||
| Ⅰ | 600℃ | 1mol | 3mol |
| Ⅱ | 800℃ | 1.5mol | 0.5mol |
| A. | 实验 I中,10 min内平均反应速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中,a<0 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 molB,A的转化率增大 |
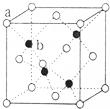 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题: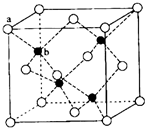 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.