题目内容
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 100mL 18.4mo1•L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | 标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA | |
| D. | 用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.3NA |
分析 A.氯水中氯元素以HClO、Cl-、ClO-、Cl2形式存在;
B.铜与稀硫酸不发生反应,所以随着反应的进行,浓硫酸变成稀硫酸后反应停止,反应生成的二氧化硫的物质的量小于0.92mol;
C.标准状况下三氯甲烷不是气体;
D.碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.05mol 碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.1molCuO、0.05molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据铜和氢气的物质的量与转移电子之间的关系式计算转移电子的物质的量.
解答 解:A.氯水中氯元素以HClO、Cl-、ClO-、Cl2形式存在,N(HClO)+N(Cl-)+N(ClO-)+2N(Cl2)=2NA,故A错误;
B.100mL 18.4mo1•L-1硫酸中含有硫酸的物质的量为1.84mol,与铜的反应中,消耗1.84mol硫酸会生成0.92mol二氧化硫气体,由于随着反应的进行,浓硫酸变成稀硫酸后反应停止,反应生成的二氧化硫的物质的量小于0.92mol,生成SO2的分子数小于0.92NA,故B错误;
C.标准状况下三氯甲烷不是气体,2.24 L三氯甲烷物质的量不是0.1mol,故C错误;
D.碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.05mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.1molCuO、0.05molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据Cu原子、H原子守恒得阴极上析出n(Cu)=0.1mol、n(H2)=0.05mol,则转移电子的物质的量=0.1mol×2+0.05mol×2=0.3mol,转移电子的数目为0.3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,明确物质的结构、可逆反应、气体摩尔体积应用条件、氧化还原反应规律、电解池工作原理是解题关键,题目难度中等.

| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(  )的一氯代物 )的一氯代物 | D. | 立体烷 ( )的二氯代物 )的二氯代物 |
| X | |||
| Y | Z | W | A |
| T | B |
| A. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| B. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
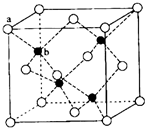 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.