题目内容
12.用离子方程式或理论解释下列现象(1)FeCl3净水原理:Fe3++3H2O?Fe(OH)3+3H+
(2)纯碱溶液中滴加酚酞显红色:CO32-+H2O?HCO3-+OH-
(3)NaAlO2溶液显碱性AlO2-+2H2O?Al(OH)3+OH-
(4)NaHCO3溶液显碱性HCO3-+H2O?H2CO3+OH-.
分析 (1)铁离子水解生成氢氧化铁和氢离子,为可逆反应;
(2)纯碱水解显碱性;
(3)偏铝酸根离子水解显碱性;
(4)碳酸氢根离子水解显碱性,为可逆反应,以此来解答.
解答 解:(1)FeCl3净水原理为Fe3++3H2O?Fe(OH)3+3H+,生成胶体具有吸附性,可净化水,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)纯碱溶液中滴加酚酞显红色的离子反应为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)NaAlO2溶液显碱性的离子反应为AlO2-+2 H2O?Al(OH)3+OH-,故答案为:AlO2-+2 H2O?Al(OH)3+OH-;
(4)NaHCO3溶液显碱性的离子反应为HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意水解原理的应用,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
7.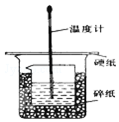 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式(离子方程式)H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol (△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此
操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温州 t1/℃ | 终止温度(t2)/℃[ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此
操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
17.把1gNaOH溶于水配制成50mL溶液,所得溶液中NaOH的物质的量浓度为( )
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
4.a L含有硫酸铵和硝酸铵的混合溶液中,加入bmol NaOH并加热,恰好把NH3全部赶出;又加入cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )mol/L.
| A. | $\frac{b}{a}$ | B. | $\frac{c}{a}$ | C. | $\frac{b-2c}{a}$ | D. | $\frac{b-c}{a}$ |
1.将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素肯定不是( )
| A. | Na | B. | Mg | C. | Cu | D. | Zn |

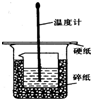 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.