题目内容
16.向体积为2L的容器中加入1molN2和6molH2,合成氨.2分钟之后达到平衡,测得氮气为0.6mol.氢气的反应速率是( )| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
分析 根据v=$\frac{\frac{△n}{V}}{△t}$计算出该时间段内用氮气表示的平均反应速率,然后利用化学反应速率与化学计量数成正比计算出氢气的反应速率.
解答 解:2分钟内用氮气表示的反应速率为:v(H2)=$\frac{\frac{1mol-0.6mol}{2L}}{2min}$=0.1 mol•L-1•min-1,
同一反应中化学反应速率与化学计量数成正比,则氢气的反应速率为:v(H2)=3v(N2)=0.1 mol•L-1•min-1×3=0.3 mol•L-1•min-1,
故选C.
点评 本题考查了化学反应速率的计算,题目难度不大,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验.请回答相关问题.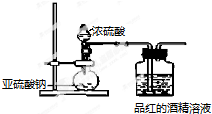
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
②根据实验和分析,该同学得出的结论是主要是SO32-有漂白作用.

(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
7.含有1.204×1024个分子的某物质的质量为56g,则该物质的相对分子质量为( )
| A. | 14 | B. | 28 | C. | 2.8 | D. | 280 |
4.下列实验的反应原理用离子方程式表示正确的是( )
| A. | 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3•H2O+H3O+ | |
| B. | 将16.8g铁粉投入100mL4.0mol/L的HNO3溶液中(还原产物只有NO):6Fe+20H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| D. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
1.下列说法不正确的是( )
| A. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| B. | 石油分馏得到的汽油、煤油、柴油等各种沸点范围不同的混合物 | |
| C. | 通过石油裂化和裂解可以获得轻质油和重要化工原料(乙烯、丙烯等) | |
| D. | 天然气和沼气的主要成分是甲烷,它们都属于不可再生能源 |
8.相同质量的下列各烃,完全燃烧后生成水最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙醇 | D. | 苯乙烯 |
5.如图实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  蒸馏 | ||
| C. |  过滤 | D. |  稀释浓硫酸 |
6.以下反应不符合绿色化学原子经济性要求的是( )
| A. | CH≡CH+HCl→CH2=CHCl | B. |  | ||
| C. | CH2=CH2+HCl→CH3CH2Cl | D. |  |