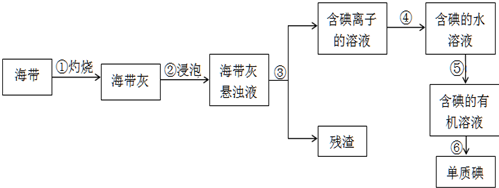
题目内容
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为
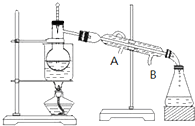
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如右图,请结合化学用语从化学平衡的角度解释:
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.肼--空气燃料电池是一种碱性电池,该电池放电时,负极的反应式
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物.首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙.已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式
考点:氨的化学性质,化学电源新型电池,二氧化硫的化学性质,常见的生活环境的污染及治理
专题:元素及其化合物
分析:(1)氨气分子中氮原子和每个H原子之间都存在一对共用电子对;
(2)实验室用氯化铵和氢氧化钙加热制取氨气;
(3)氨气溶于水生成一水合氨、一水合氨电离生成铵根离子和氢氧根离子,氨气、一水合氨和铵根离子之间都存在平衡关系,溶液中氢氧根离子浓度增大,抑制氨气溶解;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(5)燃料电池中,负极上燃料失电子发生氧化反应;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水.
(2)实验室用氯化铵和氢氧化钙加热制取氨气;
(3)氨气溶于水生成一水合氨、一水合氨电离生成铵根离子和氢氧根离子,氨气、一水合氨和铵根离子之间都存在平衡关系,溶液中氢氧根离子浓度增大,抑制氨气溶解;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(5)燃料电池中,负极上燃料失电子发生氧化反应;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水.
解答:
解:(1)氨气分子中氮原子和每个H原子之间都存在一对共用电子对,且N原子还有一个孤电子对,所以氨气电子式为 ,故答案为:
,故答案为: ;
;
(2)实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;
(3)NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出,故答案为:NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应,反应方程式为2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-=N2+4H2O,故答案为:N2H4+4OH--4e-=N2+4H2O;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水,反应方程式为3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O,故答案为:3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O.
 ,故答案为:
,故答案为: ;
;(2)实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为Ca(OH)2+2NH4Cl
| ||
| ||
(3)NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出,故答案为:NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应,反应方程式为2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-=N2+4H2O,故答案为:N2H4+4OH--4e-=N2+4H2O;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水,反应方程式为3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O,故答案为:3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O.
点评:本题以氮的化合物为载体考查氧化还原反应、原电池原理等知识点,知道氨气的实验制法、化学平衡原理、原电池原理即可解答,难点是电极反应式书写,题目难度中等.

练习册系列答案
相关题目
下列溶液通入过量的CO2后无沉淀有的( )
| A、CaCl2 |
| B、Ca(ClO)2 |
| C、Na2SiO3 |
| D、饱和Na2CO3溶液 |
 此烃名称为
此烃名称为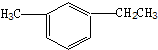 的烃可命名为
的烃可命名为 的烃可命名为:
的烃可命名为: 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.