题目内容
 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.(1)根据等电子原理,写出CO分子的结构式
(2)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液共热生成Cu2O沉淀.
①写出甲醇催化氧化制甲醛的化学方程式
②已知乙醛与新制Cu(OH)2反应的化学方程式为:CH3CHO+Cu(OH)2
| △ |
③甲醇的沸点比甲醛的高,其主要原因是
④甲醛分子中碳原子轨道的杂化类型为
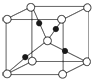
⑤如图是Cu2O的晶胞结构示意图,其中,黑球代表
考点:“等电子原理”的应用,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)根据等电子原理来书写CO的结构式;
(2)①甲醇发生催化氧化生成甲醛和水;
②甲醛和新制氢氧化铜反应是利用了醛基的性质,甲醛和新制氢氧化铜反应生成氧化亚铜、二氧化碳和水;
③利用氢键来解释物质的沸点;
④利用氢键来解释物质的沸点,利用甲醛中的成键来分析碳原子的杂化类型;利用杂化类型来分析空间结构;
⑤利用晶胞结构图,根据铜原子的数目来分析其位置.
(2)①甲醇发生催化氧化生成甲醛和水;
②甲醛和新制氢氧化铜反应是利用了醛基的性质,甲醛和新制氢氧化铜反应生成氧化亚铜、二氧化碳和水;
③利用氢键来解释物质的沸点;
④利用氢键来解释物质的沸点,利用甲醛中的成键来分析碳原子的杂化类型;利用杂化类型来分析空间结构;
⑤利用晶胞结构图,根据铜原子的数目来分析其位置.
解答:
解:(1)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为N≡N,互为等电子体分子的结构相似,则CO的结构式为C≡O;
故答案为:C≡O;
(2)①甲醇发生催化氧化生成甲醛和水,反应的方程式为:2CH3OH+O2
2HCHO+2H2O;
故答案为:2CH3OH+O2
2HCHO+2H2O;
②甲醛和新制氢氧化铜反应是利用了醛基的性质,甲醛和新制氢氧化铜反应生成氧化亚铜、二氧化碳和水,甲醛和新制氢氧化铜反应方程式为:HCHO+4Cu(OH)2
2Cu2O+5H2O+CO2↑;
故答案为:HCHO+4Cu(OH)2
2Cu2O+5H2O+CO2↑;
③甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;
故答案为:甲醇分子间形成氢键;
④甲醛分子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化;
故答案为:sp2杂化;平面三角形;
⑤在氧化亚铜晶胞中,白球的数目为8×
+1=2,黑球的数目为4,即白球数目:黑球数目=1:2,故黑球为铜原子.
故答案为:Cu.
故答案为:C≡O;
(2)①甲醇发生催化氧化生成甲醛和水,反应的方程式为:2CH3OH+O2
| Cu/Ag |
| △ |
故答案为:2CH3OH+O2
| Cu/Ag |
| △ |
②甲醛和新制氢氧化铜反应是利用了醛基的性质,甲醛和新制氢氧化铜反应生成氧化亚铜、二氧化碳和水,甲醛和新制氢氧化铜反应方程式为:HCHO+4Cu(OH)2
| △ |
故答案为:HCHO+4Cu(OH)2
| △ |
③甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;
故答案为:甲醇分子间形成氢键;
④甲醛分子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化;
故答案为:sp2杂化;平面三角形;
⑤在氧化亚铜晶胞中,白球的数目为8×
| 1 |
| 8 |
故答案为:Cu.
点评:本题主要考查等电子体原理、分子间作用力、杂化轨道、分子的平面构型,注重了对物质结构中常考考点的综合,学生易错点在电子排布中3d与4s的书写上及杂化类型的判断上.

练习册系列答案
相关题目
下列说法正确的是( )
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 |
| D、钢铁发生电化学腐蚀时,负极的电极反应式为 Fe-3e-=Fe3+ |

 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位. :
: :
: :
: :
:
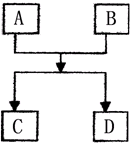 已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.
已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.