题目内容
13.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )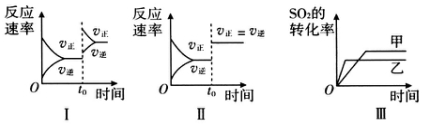
| A. | 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 | |
| C. | 图Ⅱ研究的是t0时刻加入催化剂对化学平衡的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
分析 A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
B.通入氦气,各组分的浓度不变,平衡不发生移动;
C.加入催化剂,正逆反应速率都增大,但速率相等,平衡不移动;
D.正反应放热,升高温度,平衡向逆反应方向移动.
解答 解:A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅰ应是增大压强的原因,故A错误;
B.通入氦气,各组分的浓度不变,正逆反应速率不变,平衡不发生移动,故B错误;
C.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故C正确;
D.乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO2的转化率减小,故D正确;
故选:CD.
点评 本题考查外界条件对化学反应速率、化学平衡的影响,题目难度中等,答题时注意:(1)若t0时刻无断点,则平衡移动肯定是改变某一物质的浓度导致.(2)若t0时刻有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度②改变反应体系的压强;③改变反应体系的温度.

练习册系列答案
相关题目
4.实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如图1:
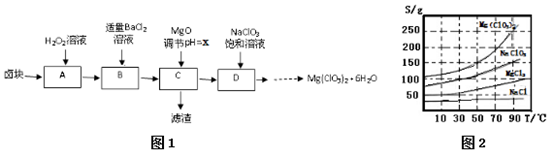
已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
②室温时一些物质的Ksp如表:
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为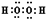
(2)滤渣的成分是Fe(OH)3、BaSO4(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为3.3
(4)D中所发生的化学反应方程式式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,框图中由D→…→制Mg(ClO3)2•6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤(请补充);③冷却结晶;④过滤洗涤.
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL试液于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000mol/L的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点.
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果偏小(填“偏大”.“偏小”或“不变”).
③若平均消耗K2Cr2O7溶液15.00mL,则产品中Mg(ClO3)2•6H2O(其M=299g/mol)的质量分数为78.3%.

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
②室温时一些物质的Ksp如表:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
(1)H2O2的电子式为
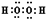
(2)滤渣的成分是Fe(OH)3、BaSO4(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为3.3
(4)D中所发生的化学反应方程式式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,框图中由D→…→制Mg(ClO3)2•6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤(请补充);③冷却结晶;④过滤洗涤.
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL试液于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000mol/L的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点.
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果偏小(填“偏大”.“偏小”或“不变”).
③若平均消耗K2Cr2O7溶液15.00mL,则产品中Mg(ClO3)2•6H2O(其M=299g/mol)的质量分数为78.3%.
1.下列实验操作中正确的是( )
| A. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| B. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
8.西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害.已知其相关性质如表所示:
(1)氯元素基态原子核外电子的成对电子数为16,氯吡苯脲中所含元素能形成10电子分子,且分子之间能形成氢键的有NH3、H2O.(填二种,填化学式)
(2)氯吡苯脲的晶体类型为分子晶体.该分子是由极性、非极性键形成的极性分子(填“极性”或“非极性”)
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |  | 白色结晶粉末 | 170~172°C | 易溶于水 |
(2)氯吡苯脲的晶体类型为分子晶体.该分子是由极性、非极性键形成的极性分子(填“极性”或“非极性”)
18.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )


| A. | 铜是负极,电子从铜片经导线流向锌片 | |
| B. | 大多数氢离子在锌片上获得电子被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成西红柿汁,导线中不会有电子流动 |
5.用下列装置完成相关实验,合理的是( )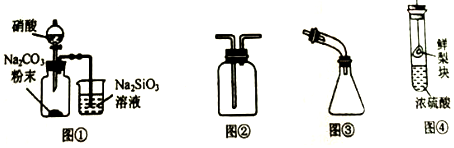

| A. | 图①:证明非金属性由强到弱的顺序是N>C>Si | |
| B. | 图②:收集NO2或NH3 | |
| C. | 图③:海水蒸馏时接收蒸馏水 | |
| D. | 图④:探究浓硫酸的脱水性 |
2.某固体化合物的化学式NH5,它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )
| A. | 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ | |
| B. | NH5中只有极性共价键的共价化合物 | |
| C. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数) | |
| D. | NH5中所有原子最外层均为8个电子 |