题目内容
2.碘是人体不可缺乏的元素,为了防止碘缺乏,市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4═3I2+3H2O+3K2SO4.请回答下列问题:
(1)该反应中氧化剂是KIO3,每生成1mol I2转移电子物质的量是$\frac{5}{3}$mol.
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的苯,振荡,观察到的现象是溶液分成两层,下层无色,上层呈紫红色.
(3)在容量瓶的使用方法中,下列操作正确的是BC(填字母).
A.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线
1~2cm处,用胶头滴管加蒸馏水至刻度线
B.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
C.使用容量瓶前检验是否漏水
D.容量瓶用水洗净后,再用待配溶液洗涤
(4)用容量瓶配制一定物质的量浓度的稀硫酸,下面操作造成所配稀硫酸溶液浓度偏高的是BD(填字母).
A.转移时没有洗涤烧杯、玻璃棒
B.溶解的时候溶液没有冷却到室温就转移并定容
C.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
D.向容量瓶加水定容时眼睛俯视液面.
分析 (1)KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4中,元素化合价降低的做氧化剂,反应中1molKIO3反应生成3molI2,电子转移5mol;
(2)碘易溶于有机溶剂,四氯化碳的密度比水大,有机层在下层,碘溶于四氯化碳呈紫红色,上层几乎无色;
(3)根据容量瓶的使用方法和注意事项来回答问题;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析对所配溶液浓度的影响.
解答 解:(1)KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4中,元素化合价降低的做氧化剂,反应中1molKIO3反应生成3molI2,电子转移5mol,每生成1mol I2转移电子物质的量是$\frac{5}{3}$mol,
故答案为:KIO3;$\frac{5}{3}$mol;
(2)碘易溶于有机溶剂,在四氯化碳在的溶解度远大于在水中,加入四氯化碳萃取水中的碘,四氯化碳与水不互溶,溶液分成两层,四氯化碳的密度比水,有机层在下层,碘溶于四氯化碳呈紫红色,上层几乎无色,
故答案为:溶液分成两层,上层无色,下层呈紫红色;
(3)A.不能在容量瓶中进行稀释,应在烧杯中进行操作,冷却后再转移到容量瓶中,故A错误;
B.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,目的是摇匀溶液,故B正确;
C.使用容量瓶前检查其是否漏水,否则配制溶液的浓度有误差,故C正确;
D.容量瓶用蒸馏水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,配制溶液的浓度偏高,故D错误;
故答案为:BC;
(4)A.转移时没有洗涤烧杯、玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A错误;
B.溶解的时候溶液没有冷却到室温就转移,溶液冷却后体积偏小,配制的溶液浓度偏高,故B正确;
C.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,配制的溶液体积偏大,溶液浓度偏小,故C错误;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,故D正确;
故答案为:BD.
点评 本题考查萃取、氧化还原反应、一定物质的量浓度溶液配制等,难度中等,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

 阅读快车系列答案
阅读快车系列答案
| A. | 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 | |
| C. | 图Ⅱ研究的是t0时刻加入催化剂对化学平衡的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验淀粉是否水解 | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热沸腾 |
| D | 证明SO2有漂白性 | 将SO2通入酸性高锰酸钾溶液中 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 应研发新型高效催化剂以提高合成氨工业中氨的产率 | |
| B. | 糖尿病患者不能食用含糖类的物质 | |
| C. | 空气中NO和NO,等氮氧化物含量过高可导致光化学烟雾或酸雨的形成 | |
| D. | “84”消毒液与漂白粉溶液的有效成分均是Ca( ClO)2,均具有消毒杀菌能力 |

| A. | 简单离子半径:Z<Y | B. | 非金属性:X>Y | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | W2Y2中含有共价键 |
| A. | 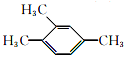 1,2,4-三甲苯 1,2,4-三甲苯 | B. |  2,2,4,4一四甲基戊烷 2,2,4,4一四甲基戊烷 | ||
| C. | 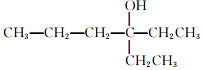 1,1-二乙基-1-丁醇 1,1-二乙基-1-丁醇 | D. |  1,3--溴丙烷 1,3--溴丙烷 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: