题目内容
1.下列实验操作中正确的是( )| A. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| B. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
分析 A.甲苯与高锰酸钾反应,苯与高锰酸钾不反应;
B.苯不与溴水反应,制取溴苯应该用液溴;
C.浓硫酸缓缓注入到浓硝酸中,最后加苯;
D.制备氢氧化铜浊液时,加入的氢氧化钠必须过量.
解答 解:A.甲苯与高锰酸钾反应,能使高锰酸钾溶液褪色,苯与高锰酸钾溶液不反应,可鉴别甲苯和苯,故A正确;
B.制取溴苯的原料为:铁屑、液溴和苯,苯与溴水不反应,故B错误;
C.实验室制取硝基苯时,应该把浓硫酸缓缓注入到浓硝酸中并及时搅拌冷却,最后逐滴加入苯,边加边振荡,使混酸与苯混合均匀,故C错误;
D.用新制氢氧化铜悬浊液检验醛基时,必须是在碱性条件下,该实验中NaOH不足导致NaOH和硫酸铜混合溶液不是碱性,所以实验不成功,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及常见有机物制备、物质检验与鉴别、官能团检验等知识点,明确实验原理、物质性质及其性质差异性是解本题关键,侧重考查学生分析判断能力,易错选项是D.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
11.现有H2、CO(体积比为3:2)的混合气体a L,在相同条件下,当其完全燃烧时所需O2体积为( )
| A. | 0.5 a L | B. | a L | C. | 2 a L | D. | 3 a L |
12.10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为6mL(相同状况),则NO和CO2的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 1:2 |
16.下列食品中富含油脂的是( )
| A. | 苹果 | B. | 大米 | C. | 白菜 | D. | 花生 |
6.如图是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:
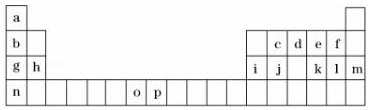
(1)元素o为25号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d54s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)F>O>N.
(4)o、p两元素的部分电离能数据列于表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态较稳定.

(1)元素o为25号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d54s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)F>O>N.
(4)o、p两元素的部分电离能数据列于表:
| 元素 | O | P | |
| 电离能/KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
13.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
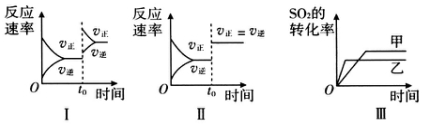

| A. | 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 | |
| C. | 图Ⅱ研究的是t0时刻加入催化剂对化学平衡的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
10.科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )
| A. | 任意位置寻找 | B. | 稀有气体元素中寻找 | ||
| C. | 金属和非金属的分界线处寻找 | D. | 活泼金属和活泼非金属区中寻找 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: