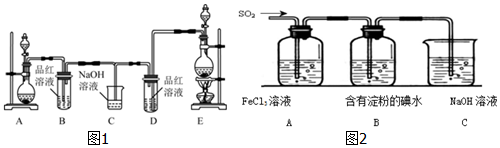
题目内容
1.下列物质制备的方程式正确的是( )| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H2O+CaO═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:3Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O |
分析 A.二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
B.浓硫酸化学式不能拆;
C.实验室用加热氯化铵与氢氧化钙反应制取氨气;
D.不符合反应客观事实,且电荷数不守恒,铜与浓硝酸反应生成二氧化氮.
解答 解:A.二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故A正确;
B.实验室制二氧化硫,离子方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O+SO42-,故B错误;
C.实验室用加热氯化铵与氢氧化钙反应制取氨气,方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故C错误;
D.实验室制二氧化氮,离子方程式:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故D错误;
故选:A.
点评 本题考查了物质的制备,侧重考查方程式、离子方程式书写,明确物质的制备是解题关键,注意离子方程式、化学方程式书写遵循客观事实,题目难度不大.

练习册系列答案
相关题目
11.已知1gH2完全燃烧生成水蒸气放出热量为121kJ,有关数据如下:O=O(键能为496kJ•mol-1)、H-H(键能为436kJ•mol-1),试求H2O(g)中H-O键的键能为( )
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |
6.镁铁合金6.8g溶于300mL2mol/L的盐酸,在标准状况下放出气体的体积为5.6L,向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
| A. | 5.1g | B. | 10.2g | C. | 13.6g | D. | 15.3g |
7.随着社会的发展,人们日益重视环境问题,下列做法或说法不正确的是( )
| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
4.下列有关物质性质排列顺序正确的是( )
| A. | 沸点:NH3>H2O>H2S | |
| B. | 酸性:H2SO4>HClO4>H3PO3 | |
| C. | 结合质子的能力:CO32->ClO->CH3COO- | |
| D. | 气态氢化物的热稳定性:H2O>HF>NH3 |
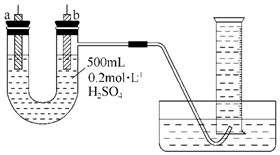 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.