题目内容
12.图为雾霾的主要成分示意图.下列说法正确的是( )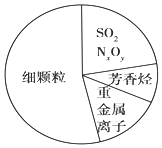
| A. | 雾霾天气不能产生丁达尔现象 | |
| B. | 重金属离子对人体的危害主要是造成蛋白质的变性 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,可杜绝雾霾的发生 |
分析 A.雾霾是胶体具有丁达尔效应;
B.重金属离子都有较多空轨道易于蛋白质形成配离,使体内的蛋白质凝固及变性;
C.NxOy组成未知,不一定是酸性氧化物;
D.道路限行可减少汽车尾气排放,污染企业停工可减少污染.
解答 解:A.胶体具有丁达尔效应,溶液和浊液不具有丁达尔效应,因此利用丁达尔效应可检验雾霾是否为胶体,故A错误;
B.重金属离子都有较多空轨道易于蛋白质形成配离子,形成配离子后蛋白质功能就丧失,使体内的蛋白质凝固及变性,故B正确;
C.二氧化硫为酸性氧化物,但NxOy组成未知,不一定是酸性氧化物,故C错误;
D.道路限行可减少汽车尾气排放,污染企业停工可减少污染,可减轻雾霾、保证空气质量,但不能杜绝雾霾的形成,故D错误;
故选B.
点评 本题考查了蛋白质、胶体的性质、芳香烃的、酸性氧化物的定义,涉及知识点广,均为基础性知识,熟练掌握物质的性质和概念是解题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列物质的电子式书写正确的是( )
| A. | H:H | B. | 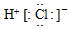 | C. | 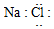 | D. | 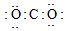 |
20.工业上通过2Al2O3+3C+6Cl2$\frac{\underline{\;高温\;}}{\;}$4AlCl3+3CO2制取无水氯化铝,下列说法正确的是( )
| A. | AlCl3是氧化产物 | B. | 每生成1molCO2,转移2mol电子 | ||
| C. | Cl2是氧化剂 | D. | C发生还原反应 |
7.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶滚为KOH溶液,反应为2Zn+O2+4OH-+2H2O=2Zn(OH)42-.下列说法正确的是( )
| A. | 放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42- | |
| B. | 充电时,电解质溶液中K+向阳极移动 | |
| C. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
4.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 在沸水中滴入含0.1molFeC13的饱和溶液,制得胶粒数为0.1 NA | |
| B. | 含0.4mol HNO3的稀硝酸与足量Fe反应,转移电子数为1.2 NA | |
| C. | 120 gNaHSO4和MgSO4的晶体混合物中阳离子数为NA | |
| D. | 标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2NA |
1.高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,具有能量密度大、体积小、重量轻、寿命长、无污染等优点,除比亚迪外目前还没有其他厂家宣称其产品可以大规模实用化.电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
13. 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
Ⅰ催化还原法.在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质.主要反应如下::2NO(g)+2CO(g)?N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-751kJ•mol-1
(2)在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)?N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示.
①前10分钟内用氮气表示的反应速率为0.02mol?L-1?min-1,计算该温度下反应的平衡常数K为$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$L?mol-1.(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO1.6mol、CO20.4mol,则此时反应的ν正=ν逆(填“<”、“=”或“>”)
程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$ NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}水溶液}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;
若生成11.2L N2(标准状况),则消耗ClO267.5g.
 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.Ⅰ催化还原法.在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质.主要反应如下::2NO(g)+2CO(g)?N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
| 化学键 | O═O | C═O | C≡O |
| 键能(Kj/moL) | 497 | 803 | 1072 |
(2)在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)?N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示.
①前10分钟内用氮气表示的反应速率为0.02mol?L-1?min-1,计算该温度下反应的平衡常数K为$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$L?mol-1.(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO1.6mol、CO20.4mol,则此时反应的ν正=ν逆(填“<”、“=”或“>”)
程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$ NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}水溶液}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;
若生成11.2L N2(标准状况),则消耗ClO267.5g.

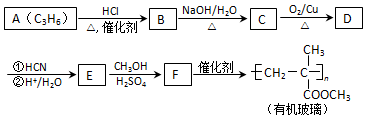
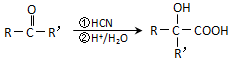 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)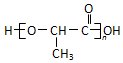 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线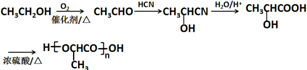 .(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)
.(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)