题目内容
7.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶滚为KOH溶液,反应为2Zn+O2+4OH-+2H2O=2Zn(OH)42-.下列说法正确的是( )| A. | 放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42- | |
| B. | 充电时,电解质溶液中K+向阳极移动 | |
| C. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
分析 根据2Zn+O2+4OH-+2H2O═2Zn(OH)42-可知,O2中元素的化合价降低,被还原,应为原电池正极,Zn元素化合价升高,被氧化,应为原电池负极,电极反应式为Zn+4OH--2e-═Zn(OH)42-,充电时阳离子向阴极移动,以此解答该题.
解答 解:A.放电时,负极反应式为Zn+4OH--2e-═Zn(OH)42-,故A正确;
B.充电时阳离子向阴极移动,即充电时,电解质溶液中K+向阴极移动,故B错误;
C.充电时,电池反应为Zn(OH)42-+2e-═Zn+4OH-,电解质溶液中c(OH-)逐渐增大,故C错误;
D.放电时,每消耗标况下22.4L氧气,即1mol,转移电子4mol,故D错误.
故选A.
点评 本题考查原电池与电解池的基础知识,正确判断正负极、阴阳极,注意电极反应式的书写及电子转移的计算,正确判断化合价的变化为解答该题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列操作会造成所配溶液的浓度偏低是的( )
| A. | 用烧杯盛氢氧化钠称量 | |
| B. | 浓硫酸溶解后立即转移到容量瓶内 | |
| C. | 用量筒量硫酸时俯视刻度 | |
| D. | 用量筒量硫酸时,倾倒后量筒没有洗涤 |
12.图为雾霾的主要成分示意图.下列说法正确的是( )


| A. | 雾霾天气不能产生丁达尔现象 | |
| B. | 重金属离子对人体的危害主要是造成蛋白质的变性 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,可杜绝雾霾的发生 |
19.下列化学用语的描述不正确的是( )
| A. | 烧碱的分子式为NaOH | |
| B. | 中子数为15的硅原子:${\;}_{14}^{20}$Si | |
| C. | 乙醇的结构简式:C2H5OH | |
| D. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- |
16.高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%.回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是N2、CO(写化学式).
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+$\frac{1}{2}$O2(g)△H=+35.7kJ/mol.
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离.
①工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式CH3COOCu(NH3)2(aq)+CO(g)═CH3COOCu(NH3)2•CO(aq)△H<0.吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有升温或减压(写出一种即可).
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO.图是变压吸附回收高炉煤气中CO的流程图:

PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2脱除(保证PSA-I吸附CO2的时间),“放空气体”的主要成分为氮气.
(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g).该反应在不同温度下的平衡常数如表所示:
①该反应的△H<0(填“>““<”或“=“).
②欲提高上述反应中CO 的转化率,可采取的措施是ab.
a.适当降低反应体系的温度
b.及时移出体系中的CO
c.加入合适的催化剂
d.减小容器的容积
e.增大Fe2O3的量.
(1)上述提及的气体分子中,电子数相等的两种气体是N2、CO(写化学式).
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+$\frac{1}{2}$O2(g)△H=+35.7kJ/mol.
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离.
①工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式CH3COOCu(NH3)2(aq)+CO(g)═CH3COOCu(NH3)2•CO(aq)△H<0.吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有升温或减压(写出一种即可).
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO.图是变压吸附回收高炉煤气中CO的流程图:

PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2脱除(保证PSA-I吸附CO2的时间),“放空气体”的主要成分为氮气.

(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g).该反应在不同温度下的平衡常数如表所示:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
②欲提高上述反应中CO 的转化率,可采取的措施是ab.
a.适当降低反应体系的温度
b.及时移出体系中的CO
c.加入合适的催化剂
d.减小容器的容积
e.增大Fe2O3的量.
8.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
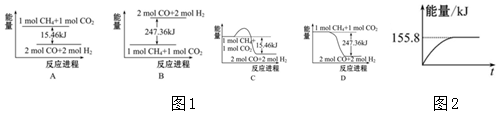
已知有关反应的能量变化如图,且方法②的反应只能在高温下发生,则方法②中反应的△H=a+3b-c kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) $?_{催化剂}^{高温、高压}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol•L-1•min-1(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol•L-1,则NH3•H2O的电离平衡常数K=1.80×10-5mol•L-1(保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
电池正极的电极反应式是N2+6e-+8H+=2NH4+,A是NH4Cl.
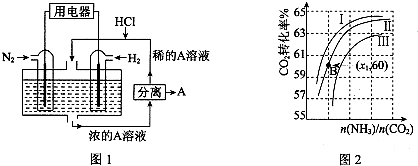
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图,且方法②的反应只能在高温下发生,则方法②中反应的△H=a+3b-c kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) $?_{催化剂}^{高温、高压}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol•L-1•min-1(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol•L-1,则NH3•H2O的电离平衡常数K=1.80×10-5mol•L-1(保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
电池正极的电极反应式是N2+6e-+8H+=2NH4+,A是NH4Cl.

(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.