题目内容
13. 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.Ⅰ催化还原法.在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质.主要反应如下::2NO(g)+2CO(g)?N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
| 化学键 | O═O | C═O | C≡O |
| 键能(Kj/moL) | 497 | 803 | 1072 |
(2)在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)?N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示.
①前10分钟内用氮气表示的反应速率为0.02mol?L-1?min-1,计算该温度下反应的平衡常数K为$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$L?mol-1.(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO1.6mol、CO20.4mol,则此时反应的ν正=ν逆(填“<”、“=”或“>”)
程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$ NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}水溶液}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;
若生成11.2L N2(标准状况),则消耗ClO267.5g.
分析 Ⅰ、(1)根据反应热=反应物的总键能-生成物的总键能,可得反应2CO+O2=2CO2的反应热,再用盖斯定律可得反应2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H;
(2)①根据图表可知,反应在10min达到平衡,列三段式,由v=$\frac{△c}{△t}$计算反应速率,由化学平衡常数概念计算;
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,计算此时,反应的浓度商与K比较判断反应进行方向;
Ⅱ、二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识书写反应方程式,通过化学反应方程式计算.
解答 解:Ⅰ、(1)根据图表键能数据,反应2CO+O2=2CO2的反应热为2×1072kJ•mol-1+497kJ•mol-1-4×803kJ•mol-1=-571kJ•mol-1,
则已知:①N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
②2CO(g)+O2(g)=2CO2(g))△H=-571kJ•mol-1
根据盖斯定律②-①可得2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-751kJ•mol-1;
故答案为:-751;
(2)①向体积为1L的密闭容器中通入2molNO、1molCO,由图可知,反应在10min达到平衡,列三段式:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
c始:2 1 0 0
c转:0.4 0.4 0.2 0.4
c平:1.6 0.6 0.2 0.4
则前10分钟内用氮气表示的反应速率为$\frac{0.2mol/L}{10min}$=0.02mol?L-1?min-1;K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$;
故答案为:0.02mol?L-1?min-1;$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$;
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,
则:此时:C(NO)=3.2mol/L;C(CO)=0.6mol/L;C(CO2)=0.8mol/L;C(N2)=0.2mol/L;
反应的浓度商为$\frac{0.2×0.{8}^{2}}{3.{2}^{2}×0.{6}^{2}}$=$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$,说明反应达到平衡,则V正=V逆;
故答案为:=;
II、二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4Na2SO3═N2+4Na2SO4;结合化学反应2NO+ClO2+H2O=NO2+HNO3+HCl知道,N2~2NO2~2ClO2,所以若生成11.2L即0.5molN2(标准状况),则消耗1molClO2质量是1mol×67.5g/mol=67.5g;
故答案为:2NO2+4Na2SO3═N2+4Na2SO4;67.5.
点评 本题考查了反应热、反应平衡的计算,氧化还原反应的相关计算,题目综合性强,明确化学平衡移动原理读取题目信息是解题关键,题目难度中等

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
| A. | 雾霾天气不能产生丁达尔现象 | |
| B. | 重金属离子对人体的危害主要是造成蛋白质的变性 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,可杜绝雾霾的发生 |
步骤I,取该溶液10.0mL,加入过量1.0mol/L Ba(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色;
步骤Ⅱ.向I所得的溶液中加入过量1.0mol/L NaOH溶液,有红褐色沉淀C和无色刺激性气体D生成.用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤Ⅲ.向Ⅱ所得的溶液中通入过量CO2有沉淀E生成.
下列推断错误的是( )
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
(2)实验②中,该反应的平衡常数K=1;
(3)实验③中,此时化学反应速率是v(正)<v(逆)(填“=”、“>”或“<”);
(4)反应热△H<0(填“>”或“<”);
(5)应用化学反应速率与化学平衡原理解决化工生产实际问题,你认为下列说法不正确的是c(填字母序号).
a.化学反应速率理论可以指导怎样在一定时间内快出产品
b.勒夏特列原理可以指导怎样使有限原料多出产品
c.催化剂的使用是提高产品产率的有效办法
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图,且方法②的反应只能在高温下发生,则方法②中反应的△H=a+3b-c kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) $?_{催化剂}^{高温、高压}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol•L-1•min-1(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol•L-1,则NH3•H2O的电离平衡常数K=1.80×10-5mol•L-1(保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
电池正极的电极反应式是N2+6e-+8H+=2NH4+,A是NH4Cl.
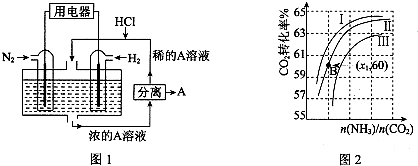
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.
| A. | 苯酚呈弱酸性,能够使石蕊试液显红色 | |
| B. | 提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| C. | 苯酚能够与氯化铁溶液反应生成紫色沉淀 | |
| D. | 苯酚分子中的13个原子可能处于同一平面上 |

 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白: