题目内容
17.下列说法正确的是( )| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
分析 A.四氯化碳标准状况为液体;
B.摩尔质量是以g/mol为单位,数值上等于其相对原子质量或相对分子质量;
C.标准状况下气体摩尔体积为22.4L/mol,使用条件是标准状况;
D.NO2和N2O4的最简式相同为NO2,只需计算46g NO2中所含原子数;
解答 解:A.标准状况下,四氯化碳为液体不是气体,1 mol CCl4的体积不是22.4L,故A错误;
B.NaOH的摩尔质量是40g/mol,故B错误;
C.标准状况下11.2L氧气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,和铜反应电子转移=0.5mol×4×NA=2NA,常温常压下,11.2L氧气物质的量不是0.5mol,电子转移不是2NA,故C错误;
D.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数=$\frac{46g}{46g/mol}$×3×NA=3NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
7.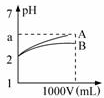 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )| A. | a=5时,A是强酸,B是弱酸 | |
| B. | 若A、B都是强酸,则5>a>2 | |
| C. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| D. | A、B两种酸溶液的物质的量浓度一定相等 |
5.化学与人类关系密切.下列有关物质的用途及其解释的说法正确的是( )
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
12.离子方程式正确的是( )
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
7.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
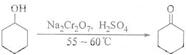
环己醇、环己酮和水的部分物理性质见下表:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应.反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物.
①酸性Na2Cr2O7溶液的加料方式为缓慢滴加.
②蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的混合物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层.
(3)利用红外光谱图,可确定环己酮分子含官能团名称羰基.
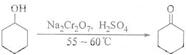
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应.反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物.
①酸性Na2Cr2O7溶液的加料方式为缓慢滴加.
②蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的混合物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层.
(3)利用红外光谱图,可确定环己酮分子含官能团名称羰基.

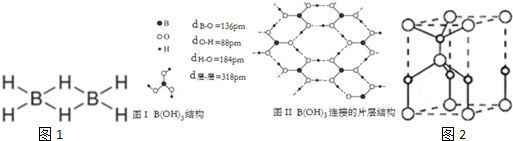
 ;
;