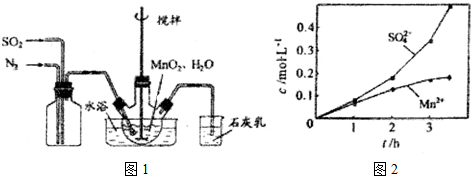
题目内容
12.离子方程式正确的是( )| A. | 0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
分析 A.等体积混合,物质的量相同,生成硫酸钡和氢氧化铝,铵根离子实际不参加反应;
B.生成Cu和氯气;
C.氯气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,n(FeBr2)=0.2L×2mol/L=0.4mol,由电子守恒可知,亚铁离子全部被氧化,溴离子部分被氧化;
D.Fe过量,生成硝酸亚铁、二氧化氮和水.
解答 解:A.0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合的离子反应为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故A错误;
B.用惰性电极电解CuCl2溶液的离子反应为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故B错误;
C.将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-,故C正确;
D.铁粉中滴加少量浓硝酸的离子反应为Fe+2NO3-+4H+=Fe2++2NO2↑+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
2.下列说法不正确的是( )
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
7.原予序数依次增大的四种短周期元素X、Y、Z、W,X元素组成的单质在自然界中硬度最大,Y元素的原子最外层电子数是次外层电子数的三倍,W元素与Y元素组成的化合物既能与酸反应又能与碱反应,Z元素的原子最外层只有一个电子.下列叙述错误的是( )
| A. | 元素金属性:Z>W | |
| B. | X与Y可形成多种共价化合物 | |
| C. | 化合物Z2Y2中既含离子键,又含共价键 | |
| D. | Y元素只能形成一种单质 |
17.下列说法正确的是( )
| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.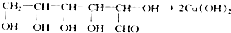 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$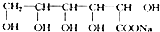 +Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
+Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;