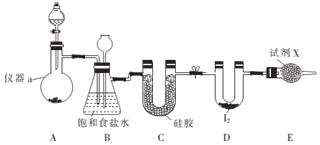
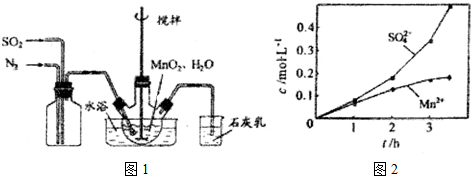
题目内容
7.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: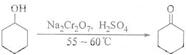
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应.反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物.
①酸性Na2Cr2O7溶液的加料方式为缓慢滴加.
②蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的混合物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层.
(3)利用红外光谱图,可确定环己酮分子含官能团名称羰基.
分析 (1)为了防止Na2Cr2O7在氧化环己醇放出大量热,使副反应增多,应让其反应缓慢进行,在加入Na2Cr2O7溶液时应缓慢滴加;依据题目信息,环己酮能与水形成具有固定组成的混合物,两者能一起被蒸出;
(2)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;
(3)根据环己酮的结构简式可知,环己酮分子含官能团名称;
解答 解:(1)由于酸性Na2Cr2O7溶液氧化环己醇反应剧烈,导致体系温度迅速上升、副反应增多,所以酸性Na2Cr2O7溶液加入不能太快,应用酸式滴定管缓慢滴加;环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被一起蒸出,所以蒸馏难以分离环己酮和水的混合物.环己酮和水能够产生共沸,采取蒸馏是不可取的,建议采用精馏,
故答案为:①缓慢滴加;②环已酮和水形成具有固定组成的混合物一起蒸出;
(2)联系制取肥皂的盐析原理,即增加水层的密度,有利于分层,环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,故顺序为c d b a,分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器,
故答案为:①c d b a;②漏斗、分液漏斗;③增加水层的密度,有利于分层;
(3)根据环己酮的结构简式可知,环己酮分子含官能团名称为羰基,
故答案为:羰基.
点评 本题考查学生的读图、识表能力,能够迅速在图、表中提取到有用信息,利用信息解决有关问题.主要考查知识点还有:过滤、分液以及等效氢等知识,学生要善于整合表中数据获取信息,准确把握基础实验知识,尤其是物质的分离和提纯实验操作是高中阶段经常考查的问题.

| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液 |
| A. | 1000mL 50.0g | B. | 950mL 47.5g | C. | 950mL 30.4g | D. | 1000mL 32.0g |
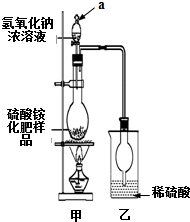 硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:
硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外 观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验检测]
(1)通常实验室检验某样品是否为铵盐,是将样品与B(填序号,下同)共热,并用C或E检验产生的气体.
A.强酸 B.强碱 C.湿润的红色石蕊试纸D.湿润的蓝色石蕊试纸
E.用蘸有浓盐酸的玻璃棒 F.用蘸有浓硫酸的玻璃棒
(2)若按图所示装置进行实验.仪器a的名称是分液漏斗;烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热,原因是:使硫酸铵充分反应完全转化为NH3,且全部进入烧杯乙.
[交流讨论]
(4)某同学根据此实验测得的数据,计算硫酸铵化肥的含氮量偏高(>21.2%),请分析实验装置中存在一个明显缺陷是:甲、乙装置间缺一个干燥装置.
[探究结论]
(5)用改进后的实验装置重新进行实验.称取13.5g硫酸铵化肥样品,测得实验前后乙装置增重3.40g.该化肥不是(填“是”或“不是”)一等品.
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c(OH-)=1×10-14mol•L-1溶液:K+、Na+、Cl-、HCO3- |