题目内容
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Cl2参加的任何反应转移电子数都是2NA |
| B、标准状况下,22.4mL水中含有的分子数目约为1.24NA |
| C、常温常压下,29g乙基(-C2H5)所含电子数为13NA |
| D、0.1mol Na2O2中含有离子总数为0.4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.1mol氯气与氢氧化钠溶液的反应中,1mol氯气转移了1mol电子;
B.22.4mL水的质量约为22.4g,根据n=
计算出水的物质的量;
C.乙基中含有17电子,29g乙基的物质的量为1mol,1mol乙基中含有17mol电子;
D.过氧化钠中阴离子为过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子.
B.22.4mL水的质量约为22.4g,根据n=
| m |
| M |
C.乙基中含有17电子,29g乙基的物质的量为1mol,1mol乙基中含有17mol电子;
D.过氧化钠中阴离子为过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子.
解答:
解:A.1mol氯气与氢氧化钠溶液反应时,1mol氯气完全反应转移了1mol电子,转移电子数都是NA,故A错误;
B.标况下,22.4mL水的质量约为22.4g,水的物质的量为:
≈1.24mol,含有的分子数目约为1.24NA,故B正确;
C.29g乙基的物质的量为1mol,1mol乙基中含有17mol电子,所含电子数为17NA,故C错误;
D.0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的离子总数为0.3NA,故D错误;
故选B.
B.标况下,22.4mL水的质量约为22.4g,水的物质的量为:
| 22.4g |
| 18g/mol |
C.29g乙基的物质的量为1mol,1mol乙基中含有17mol电子,所含电子数为17NA,故C错误;
D.0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的离子总数为0.3NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项B为易错点,注意水的密度约为1g/mL.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、沸点大小关系为:乙酸>水>乙醇>溴乙烷>甲醛 |
| B、在水中溶解度大小关系为:乙酸异戊酯<苯酚<乙醇 |
| C、用水可以区别苯、乙醛、四氯化碳、醋酸、硝基苯五种液体 |
| D、甲醛、乙酸任意比混合,等质量的混合物完全燃烧耗氧量和生成CO2量相同 |
 酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )
酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )| A、分子式为C20H14O4 |
| B、可以发生取代反应、加成反应、氧化反应 |
| C、含有的官能团有羟基、酯基 |
| D、1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
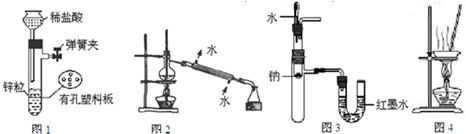

| A、用图1所示装置制取少量H2 |
| B、用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
| C、用图3所示装置验证Na和水反应的热效应 |
| D、用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
胡妥油(D)用作香料的原料,它可由A合成得到:

下列说法正确的是( )

下列说法正确的是( )
| A、若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 |
| B、有机物D分子中所有碳原子一定共面 |
| C、有机物C 的所有同分异构体中不可有芳香族化合物存在 |
| D、有机物B 既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(Ⅲ)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+═4Cr3++7O2+6H2O,下列有关说法正确的是( )


| A、CrO5中Cr元素的化合价为+10 |
| B、过氧化铬中含有极性共价键、非极性共价键和离子键 |
| C、过氧化铬是酸性氧化物,具有较强的氧化性 |
| D、上述反应每转移0.2mol电子就能生成2.24L O2 |
下列说法不正确的是( )
| A、将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | ||
| B、等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | ||
| C、某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
D、CH3COOH 溶液加水稀释后,溶液中
|