题目内容
下列说法不正确的是( )
| A、将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | ||
| B、等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | ||
| C、某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
D、CH3COOH 溶液加水稀释后,溶液中
|
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,溶液的酸碱性取决于HA的电离和A-水解程度的相对大小;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.某盐酸的pH=b,则c(HCl)=10-b mol/L,某氨水的pH=a,a+b=14,则氨水中c(OH-)=
mol/L=10-b mol/L,氨水浓度大于HCl,二者等体积混合,溶液呈碱性,再结合电荷守恒判断;
D.加水稀释醋酸促进醋酸电离,酸性减弱,则水的电离程度增大.
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.某盐酸的pH=b,则c(HCl)=10-b mol/L,某氨水的pH=a,a+b=14,则氨水中c(OH-)=
| 10-14 |
| 10-a |
D.加水稀释醋酸促进醋酸电离,酸性减弱,则水的电离程度增大.
解答:
解:A.等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,溶液的酸碱性取决于HA的电离和A-水解程度的相对大小,即取决于酸的电离平衡常数大小,故A正确;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(HClO)+2c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)=Na+,故B正确;
C.某盐酸的pH=b,则c(HCl)=10-b mol/L,某氨水的pH=a,a+b=14,则氨水中c(OH-)=
mol/L=10-b mol/L,氨水浓度大于HCl,二者等体积混合,溶液呈碱性则c(OH-)>c(H+),再结合电荷守恒得c(NH4+)>c(Cl-),溶液中一水合氨电离程度较小,所以c(Cl-)>c(OH-),故C正确;
D.加水稀释醋酸促进醋酸电离,酸性减弱,则水的电离程度增大,所以溶液中
的值增大,故D错误;
故选D.
B.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(HClO)+2c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)=Na+,故B正确;
C.某盐酸的pH=b,则c(HCl)=10-b mol/L,某氨水的pH=a,a+b=14,则氨水中c(OH-)=
| 10-14 |
| 10-a |
D.加水稀释醋酸促进醋酸电离,酸性减弱,则水的电离程度增大,所以溶液中
| c(H+) |
| c(CH3COO-) |
故选D.
点评:本题考查了离子浓度大小比较,涉及弱电解质的电离、盐类水解、混合溶液酸碱性定性判断等知识点,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒来分析解答,题目难度中等.

练习册系列答案
相关题目
2SO2+O2
2SO3是制造硫酸的重要反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Cl2参加的任何反应转移电子数都是2NA |
| B、标准状况下,22.4mL水中含有的分子数目约为1.24NA |
| C、常温常压下,29g乙基(-C2H5)所含电子数为13NA |
| D、0.1mol Na2O2中含有离子总数为0.4NA |
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期.Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2.下列说法错误的是( )
| A、Y、Z、X、W的原子序数依次减小 |
| B、X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C、由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D、W与X可形成既含极性共价键又含非极性共价键的化合物 |
下列有关电化学的说法正确的是( )
| A、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| B、电解精炼铜时阴极发生还原反应 |
| C、用铜作电极电解后的硫酸铜溶液中,加入一定量的氧化铜即可恢复溶液的成分和浓度 |
| D、铜锌原电池工作时外电路电子由锌极流向铜极,内电路电子由铜极流向锌极 |
下列化学反应对应的离子方程式表示正确的是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
下列实验操作能达到目的是( )
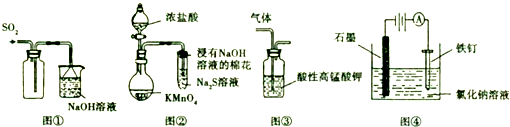

| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
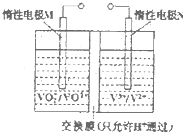 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.