题目内容
 酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )
酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )| A、分子式为C20H14O4 |
| B、可以发生取代反应、加成反应、氧化反应 |
| C、含有的官能团有羟基、酯基 |
| D、1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
考点:有机物的结构和性质,有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:由结构简式可知分子式,分子中含酚-OH、-COOC-,结合酚、酯的性质来解答.
解答:
解:A.由结构简式可知分子式为C20H14O4,故A正确;
B.含酚-OH可发生取代、氧化反应,含苯环可发生加成反应,故B正确;
C.分子中含酚-OH、-COOC-,即含有的官能团有羟基、酯基,故C正确;
D.只有苯环与氢气发生加成反应,酚-OH的邻对位与溴水发生取代,且对位均有取代基,则1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为9mol和4mol,故D错误;
故选D.
B.含酚-OH可发生取代、氧化反应,含苯环可发生加成反应,故B正确;
C.分子中含酚-OH、-COOC-,即含有的官能团有羟基、酯基,故C正确;
D.只有苯环与氢气发生加成反应,酚-OH的邻对位与溴水发生取代,且对位均有取代基,则1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为9mol和4mol,故D错误;
故选D.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、酯性质的考查,题目难度不大.

练习册系列答案
相关题目
某同学设计如图元素周期表,以下说法正确的是( )
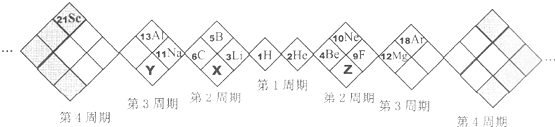

| A、X、Y、Z元素分别为N、P、O |
| B、白格中都是主族元素,灰格中都是副族元素 |
| C、原子半径:Z>X>Y |
| D、X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
2SO2+O2
2SO3是制造硫酸的重要反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
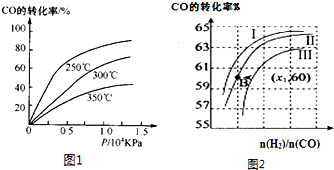
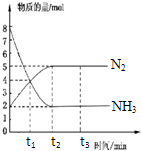 在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )
在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )| A、t1时反应达到平衡 |
| B、t3时,v正(N2)>v逆(N2) |
| C、t2时和t3时n(H2)相等 |
| D、t3后,若体积不变充He,反应速率增大 |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Cl2参加的任何反应转移电子数都是2NA |
| B、标准状况下,22.4mL水中含有的分子数目约为1.24NA |
| C、常温常压下,29g乙基(-C2H5)所含电子数为13NA |
| D、0.1mol Na2O2中含有离子总数为0.4NA |
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期.Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2.下列说法错误的是( )
| A、Y、Z、X、W的原子序数依次减小 |
| B、X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C、由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D、W与X可形成既含极性共价键又含非极性共价键的化合物 |
下列实验操作能达到目的是( )
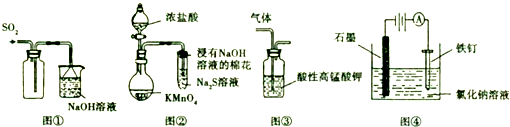

| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |