题目内容
10. 用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:
用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:①取100mL的水样加稀硫酸调节pH至1~3,加入一定量的KI溶液,振荡;
②再加入少量淀粉做指示剂后,用1.0×10-4mol/L的Na2S2O3溶液滴定
(己知:2S2O32-+I2=S4O62-+2I-).
(1)ClO2在pH至1~3时与KI溶液反应的离子方程式是2ClO2+8H++10I-=2Cl-+4H2O+5I2
(2)滴定起始和终点的液面位置如下图,则消耗Na2S2O3溶液的体积为16.50mL,水样中C1O2的浓度是0.22mg/L.
分析 (1)根据I-被氧化为I2,ClO2-还原为Cl-书写离子方程式;
(2)图示的滴定管中液面读出初读数、终读数,然后计算出消耗Na2S2O3溶液标准溶液体积;
根据关系式2ClO2~10I-~10S2O32-先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)用I-将溶液中的ClO2还原为Cl-以测定水样中C1O2的浓度,则I-被氧化为I2,氯从+4价降为-1价,碘离子从-1价被氧化为0价,故该反应的离子方程式为2ClO2+8H++10I-=2Cl-+4H2O+5I2,
故答案为:2ClO2+8H++10I-=2Cl-+4H2O+5I2;
(2)根据图示的滴定管中液面可知,滴定管中初始读数为0,滴定终点液面读数为16.50mL,所以消耗Na2S2O3标准溶液体积为16.50mL;
根据题意发生反应:2ClO2+8H++10I-=2Cl-+4H2O+5I2,2S2O32-+I2═S4O62-+2I-可知,
2ClO2~10I-~10S2O32-
2 10
3.3×10-7mol 1.0×10-4 mol/L×0.01650L
100mL的水样中m(ClO2)=n(ClO2)×M(ClO2)=3.3×10-7mol×67.5×103mg•mol-1≈0.022mg,则水样中C1O2的浓度是0.22mg•L-1,
故答案为:16.50;0.22.
点评 本题考查了物质含量的测定、中和滴定实验的应用,题目难度中等,明确物质的性质以及检验方法是解题的关键,侧重于考查学生对基础知识的综合应用能力和实验探究能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
6.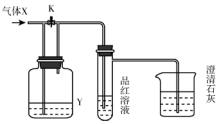 如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
 如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )| A | B | C | D | |
| X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
| Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
5.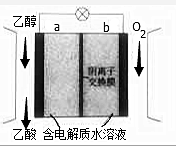 利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )
利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )
 利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )
利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )| A. | a为电池负极 | |
| B. | 电流由b极沿导线流向a 极 | |
| C. | 电池总反应为CH3CH2OH+O2=CH3COOH+H2O | |
| D. | 每生成1mol乙酸,有4molOH-迁移到b极区 |
19.原电池中正极发生的是( )
| A. | 氧化还原反应 | B. | 氧化反应 | C. | 还原反应 | D. | 置换反应 |
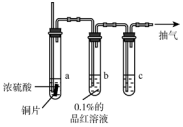 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).