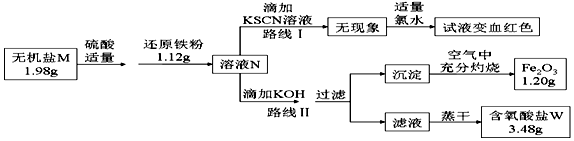
题目内容
5.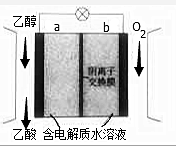 利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )
利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )| A. | a为电池负极 | |
| B. | 电流由b极沿导线流向a 极 | |
| C. | 电池总反应为CH3CH2OH+O2=CH3COOH+H2O | |
| D. | 每生成1mol乙酸,有4molOH-迁移到b极区 |
分析 该电池中氧气所在的电极为正极,乙醇所在的电极为负极,负极上发生失电子的氧化反应,正极上发生得电子的还原反应,结合溶液中离子的移动方法判断.
解答 解:A.a电极上乙醇失电子,则a为电池负极,故A正确;
B.原电池中电流从正极流向负极,即电流由b极沿导线流向a 极,故B正确;
C.该电池中乙醇被氧气氧化生成乙酸,则电池总反应为CH3CH2OH+O2=CH3COOH+H2O,故C正确;
D.a为电池负极,阴离子向负极移动,即OH-迁移到a极区,故D错误.
故选D.
点评 本题考查了原电池原理的应用,题目难度不大,明确电极的判断以及电极反应和电流、离子的移动方向即可解答,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数,以下说法正确的是( )
| A. | 标准状况下,22.4 L乙醇中分子数为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 1.8g的NH4+中含有的电子数为1.1NA | |
| D. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 |
1.分离NaCl和NH4Cl的最佳方法是( )
| A. | 加入烧碱 | B. | 利用溶解度不同,常用结晶法 | ||
| C. | 直接加热法 | D. | 加入某种合适的酸溶液 |
18.下列实验方案合理的是( )
| A. | 检验溶液中的SO42-,加入HCl酸化的Ba(NO3)2溶液,观察有无白色沉淀生成 | |
| B. | 除去NO中混有的少量NO2,将混合气体通入水中,再用排空气法收集NO | |
| C. | 用NaNO3固体与浓硫酸微热制HNO3 | |
| D. | 通入CO2以除去Na2CO3溶液中混有的NaHCO3 |
14.同温同压下两个容积相等的贮气瓶,一个装有CO,一个装有N2和CO2的混合气体,两瓶气体一定相同的是( )
| A. | 物质的量和质量 | B. | 原子总数 | C. | 分子总数 | D. | 密度 |
15.下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
| A. |  证明氨气极易溶于水 | B. |  防止倒吸 | ||
| C. |  排空气收集NO2 | D. |  分离互不相溶的两种液体 |
 用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:
用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下: