题目内容
18.a、b、c、d为原子序数依次增大的短周期主族元素,其最外层电子数之和为20,a是第二周期元素,c原子最外层电子数既是a原子内层电子总数的3倍,又是b原子最外层电子数的2倍,下列说法正确的是( )| A. | 原子半径:d>b | |
| B. | 最高价氧化物对应水化物的酸性:d>c | |
| C. | 化合物ac2中含有离子键 | |
| D. | 氧元素分别与a、b形成的化合物都是共价化合物 |
分析 a、b、c、d为原子序数依次增大的短周期主族元素,a是第二周期元素,c原子最外层电子数既是a原子内层电子总数的3倍,又是b原子最外层电子数的2倍,则c原子最外层电子数为6,b原子最外层电子数为3,四原子最外层电子数之和为20,则a、d原子最外层电子数之和为20-6-3=11,a的原子序数小于b,若b处于第二周期,a原子最外层电子数只能为1或2,d原子最外层电子数为10或9,不符合,故b处于第三周期,则b为Al,c为S,d为Cl,a原子最外层电子数为11-7=4,故a为C元素.
解答 解:a、b、c、d为原子序数依次增大的短周期主族元素,a是第二周期元素,c原子最外层电子数既是a原子内层电子总数的3倍,又是b原子最外层电子数的2倍,则c原子最外层电子数为6,b原子最外层电子数为3,四原子最外层电子数之和为20,则a、d原子最外层电子数之和为20-6-3=11,a的原子序数小于b,若b处于第二周期,a原子最外层电子数只能为1或2,d原子最外层电子数为10或9,不符合,故b处于第三周期,则b为Al,c为S,d为Cl,a原子最外层电子数为11-7=4,故a为C元素.
A.同周期自左而右原子半径减小,故原子半径d(Cl)<b(Al),故A错误;
B.非金属性d(Cl)>c(S),最高价氧化物对应水化物的酸性:d>c,故B正确;
C.化合物CS2中含有共价键,故C错误;
D.氧元素分别与a(C)、b(Al)形成的化合物中氧化铝属于离子化合物,故D错误.
故选:B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生分析推理能力以及对元素周期律的考查,难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
6.欲从苯酚的乙醇洛液中分离苯酚和乙醇,有下列操作:①蒸馏 ②过滤③静置分液④加入足量的金属钠⑤通入过量的二氧化碳⑥加入足且的NaOH溶液⑦加入足量的FeC13溶液⑧加入乙酸和浓硫酸的混合液加热.合理合理的实验操作步骤及顺序是( )
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ⑧①⑦③ | D. | ⑤②⑥③ |
13.已知:CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ•mol-1,当生成2g的H2时,吸收的热量为( )
| A. | 20.625kJ | B. | 41.25kJ | C. | 82.5kJ | D. | 165.0kJ |
10.科学史上每一次重大发现都极大的推进了科学的发展,俄国科学家门捷列夫对化学的突出贡献在于( )
| A. | 提出了元素周期律 | B. | 开发了合成氨的生产工艺 | ||
| C. | 揭示了燃烧的本质 | D. | 提取了治疟药物青蒿素 |
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 4℃时,18g 21H2168O中含有电子数为10NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的NH4NO3溶液中所含氮原子数为0.2 NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
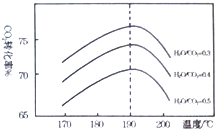 二氧化碳是一种宝贵的碳氧资源.以C02和NH3
二氧化碳是一种宝贵的碳氧资源.以C02和NH3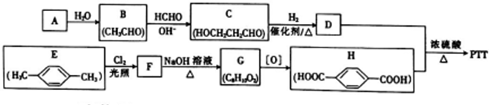
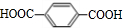 +n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$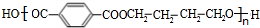 +(2n-1)H2O,该反应的反应类型为缩聚反应.
+(2n-1)H2O,该反应的反应类型为缩聚反应.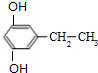 (填结构简式,任写一种)
(填结构简式,任写一种) 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):