题目内容
13.已知:CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ•mol-1,当生成2g的H2时,吸收的热量为( )| A. | 20.625kJ | B. | 41.25kJ | C. | 82.5kJ | D. | 165.0kJ |
分析 根据热化学方程式的含义进行分析解答,CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ•mol-1,生成4mol氢气,吸收165.0kJ热量,反应热与化学计量数成正比.
解答 解:2gH2的物质的量为n=$\frac{m}{M}$=$\frac{2g}{2g/mol}$=1mol,CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ•mol-1,表示生成4mol氢气,吸收165.0kJ热量,所以当生成2g的H2时,吸收的热量为$\frac{165KJ}{4}$=41.25KJ,
故选B.
点评 本题考查了热化学方程式的含义,题目难度不大,注意反应热与化学计量数成正比.

练习册系列答案
相关题目
8.以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )


| A. | a极附近溶液呈红色 | |
| B. | a极电极反应方程式是:2H++2e-=H2↑ | |
| C. | b极附近溶液呈蓝色 | |
| D. | 溶液的pH变小 |
18.a、b、c、d为原子序数依次增大的短周期主族元素,其最外层电子数之和为20,a是第二周期元素,c原子最外层电子数既是a原子内层电子总数的3倍,又是b原子最外层电子数的2倍,下列说法正确的是( )
| A. | 原子半径:d>b | |
| B. | 最高价氧化物对应水化物的酸性:d>c | |
| C. | 化合物ac2中含有离子键 | |
| D. | 氧元素分别与a、b形成的化合物都是共价化合物 |
2.有机化学中取代反应范畴很广,下列反应中,属于取代反应范畴的是( )
| A. | CH2═CH2+Br2→CH2Br-CH2Br | B. | CH3CH2CHO+HCN→CH3CH2CH(CN)OH | ||
| C. | CH3CH2OH→CH2=CH2↑+H2O | D. | CH3CH2OH+HBr→CH3CH2Br+H2O |
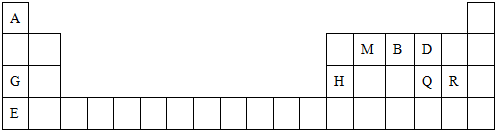
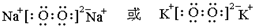 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.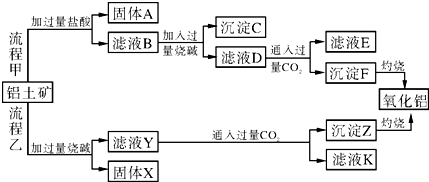
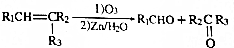
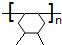 .
.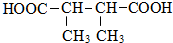 +n HOCH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2OH$→_{△}^{浓硫酸}$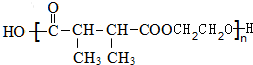 +(2n-1)H2O.
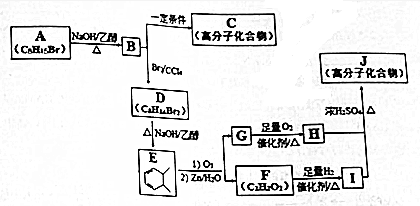
+(2n-1)H2O.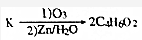 ,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式
,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式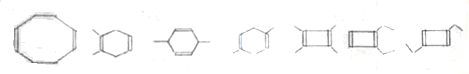 任意一种.
任意一种.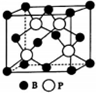 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
 ;
;