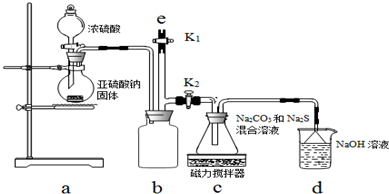
题目内容
16.NA代表阿伏加德罗常数的值.下列叙述正确的是( )| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
分析 A.质量换算为物质的量,结合1mol二氧化硅含Si-O键4mol计算判断;
B.碳酸根离子水解生成碳酸氢根子和氢氧根离子;
C.1个重水中含10mol中子和10mol质子来分析;
D.溶液体积未知.
解答 解:A.6g SiO2的物质的量为$\frac{6g}{60g/mol}$=0.1mol,含Si-O键0.4mol,故A错误;
B.碳酸根离子水解生成碳酸氢根子和氢氧根离子,所以1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数大于2NA,故B 错误;
C.标准状况下,2.0gD2O物质的量为$\frac{2.0g}{20g/mol}$=0.1mol,含有的质子数和中子数均为NA个,故C正确;
D.溶液体积未知,无法计算溶液中离子的个数,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算和应用,熟悉二氧化硅的结构、盐类水解规律、重水中所含质子数和中子数多少是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
7.如表实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
| A. | A | B. | B | C. | C | D. | D |
5.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如图:
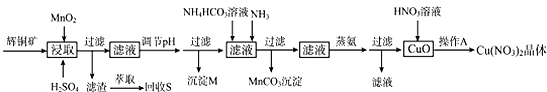
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6kg这样的辉铜矿最多能制备14.9mol无水Cu(NO3)2.(计算结果精确到小数点后1位)

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6kg这样的辉铜矿最多能制备14.9mol无水Cu(NO3)2.(计算结果精确到小数点后1位)
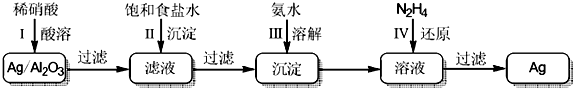
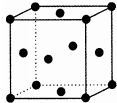 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.
X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.