��Ŀ����
8�����ۡ�8.12����ը�¹��У���ը��������軯��й©������ͨ������˫��ˮ�������������Һ���������Լ��ỷ����Ⱦ�����ϣ��軯�ƻ�ѧʽNaCN��CԪ��+2�ۣ�NԪ��-3�ۣ�����ɫ�ᾧ�������綾��������ˮ��ˮ��Һ�ʼ��ԣ���ˮ�������軯�⣮
��1��NaCNˮ��Һ�ʼ��ԣ���ԭ����CN-+H2O?HCN+OH-�������ӷ���ʽ���ͣ���
��2��NaCN��˫��ˮ��������һ����ʽ�κ�һ����ʹʪ���ɫʯ����ֽ���������壬д���÷�Ӧ�Ļ�ѧ����ʽNaCN+H2O2+H2O=NaHCO3+NH3����
ij��ѧ��ȤС��ʵ�����Ʊ���������ƣ�Na2S2O3����������������������Һ��������軯�Ʒ�ˮ�ܷ����ŷţ�
��ʵ��һ��ʵ����ͨ����ͼװ���Ʊ�Na2S2O3��
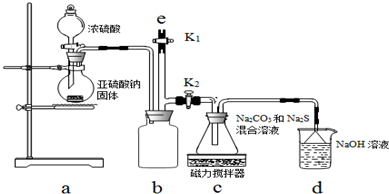
��3��aװ����ʢNa2SO3���������������Բ����ƿ��bװ�õ������ǰ�ȫƿ����ֹ������
��4��cװ���еIJ�����Na2S2O3��CO2�ȣ�dװ���е�������NaOH��Na2CO3����������Na2SO3��
��5��ʵ���������e���������ʢNaOH��Һ��ѡ�NaOH��Һ������ˮ������CCl4������һ�֣���ע�������ٹر�K2��K1����ֹ���װ��ʱ��Ⱦ������
��ʵ������ⶨ�������������Һ������ķ�ˮ���軯�Ƶĺ�����
��֪��
�ٷ�ˮ���軯�Ƶ�����ŷű�Ϊ0.50mg/L��
��Ag++2CN-=[Ag ��CN��2]-��Ag++I-=AgI����AgI�ʻ�ɫ����CN-������Ag+��Ӧ��
ʵ�����£�
ȡ25.00mL��������軯�Ʒ�ˮ����ƿ�У����μӼ���KI��Һ��ָʾ������1.000��10-4 mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ2.50mL��
��6���ζ��յ���жϷ����ǵ������һ����������Һ�����ֵ���ɫ������
��7��������ķ�ˮ���軯�Ƶĺ���Ϊ0.98mg/L��
���� ��1��NaCNΪǿ�������Σ�ˮ��ʼ��ԣ�
��2�������£��軯���������������Һ��Ӧ��������ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ���������ɵ���ʽ��Ϊ̼�����ƣ���ƽ��д����ʽ��
ʵ��һ��aװ���Ʊ���������cװ�����Ʊ�Na2S2O3����Ӧ����װ������ѹ��С��bΪ��ȫƿ���ã���ֹ��Һ������dװ�����ն���Ķ�������ֹ��Ⱦ������
��3���������ṹ��������֪ʢװNa2SO3���������ΪԲ����ƿ��bװ��Ϊ��ȫƿ��
��4��dװ�����ն�������d��������NaOH��Na2CO3������������������������ɣ�
��5���������װ��b�л��в����Ķ�������Ϊ��ֹ��Ⱦ������Ӧ������������Һ���գ�
��6��Ag+��CN-��Ӧ����[Ag��CN��2]-����CN-��Ӧ����ʱ��Ag+��I-����AgI��ɫ������˵����Ӧ����ζ��յ㣻
��7�������������������ʵ������ٸ��ݷ���ʽAg++2CN-=[Ag��CN��2]-������軯�Ƶĺ�����
��� �⣺��1��NaCNΪǿ�������Σ�ˮ��ʼ��ԣ���Ӧ�����ӷ���ʽΪ��CN-+H2O?HCN+OH-��
�ʴ�Ϊ��CN-+H2O?HCN+OH-��
��2�������£��軯���������������Һ��Ӧ��������ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ���������ɵ���ʽ��Ϊ̼�����ƣ���Ӧ����ʽΪ��NaCN+H2O2+H2O=NaHCO3+NH3����
�ʴ�Ϊ��NaCN+H2O2+H2O=NaHCO3+NH3����
ʵ��һ��aװ���Ʊ���������cװ�����Ʊ�Na2S2O3����Ӧ����װ������ѹ��С��bΪ��ȫƿ���ã���ֹ��Һ������dװ�����ն���Ķ�������ֹ��Ⱦ������
��3���������ṹ��������֪ʢװNa2SO3���������ΪԲ����ƿ��bװ��Ϊ��ȫƿ����ֹ������
�ʴ�Ϊ��Բ����ƿ����ȫƿ����ֹ������
��4��dװ�����ն�������d��������NaOH��Na2CO3������������������������ɣ�
�ʴ�Ϊ��Na2SO3��
��5���������װ��b�л��в����Ķ�������Ϊ��ֹ��Ⱦ������Ӧ������������Һ���գ�
�ʴ�Ϊ��NaOH��Һ��
��6��Ag+��CN-��Ӧ����[Ag��CN��2]-����CN-��Ӧ����ʱ���������һ����������Һ��Ag+��I-����AgI��ɫ������˵����Ӧ����ζ��յ㣬
�ʴ�Ϊ���������һ����������Һ�����ֵ���ɫ������
��7������AgNO3�����ʵ���Ϊ��2.5��10-3L��0.0001mol/L=2.50��10-7mol�����ݷ���ʽAg++2CN-=[Ag��CN��2]-�������ķ�ˮ���軯�Ƶ�����Ϊ2.50��10-7mol��2��49g/mol=2.45��10-5g����ˮ���軯�Ƶĺ���Ϊ��$\frac{2.45��1{0}^{-2}mg}{0.025L}$=0.98mg/L��
�ʴ�Ϊ��0.98��
���� ���⿼�������Ʊ�ʵ�顢���ʺ����ⶨ��֪ʶ����Ŀ�Ѷ��еȣ������ۺ��Խ�ǿ���ؼ��Ƕ�ԭ�������⣬ע���Ʊ������뻷����ʶ����������Ԫ�ػ�����֪ʶ��ʵ���Ʊ�����ԭ������������ѧ���ķ�����������������ѧʵ��������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | YԪ�غ���������Ա�W���� | |
| B�� | Z��W����Ȼ�����������̬���� | |
| C�� | YZ��YZ2�����Ա�NaOH��Һ���� | |
| D�� | X��Y���γɼȺ����Լ��ֺ��Ǽ��Լ��ķ��� |
| ��� | ���� | ���� | ���� |
| A | ��ʢ�������IJ������м�������ֲ���ͣ���ֽ��衢���� | �ϲ���Һ��ɫ���²���� | ����ɫ����ֲ�����е��ܽ�ȱ���ˮ��С |
| B | ��Ũ�Ⱦ�Ϊ0.1mol/L�Ĵ�����������Һ�зֱ�μӵ�Ũ��Na2CO3��Һ | ǰ�߲����������ݣ����������� | ����ǿ��˳���̼����� |
| C | ��̼����立ֽ����������ͨ��CaC12��Һ | ������ɫ���� | CO2��CaC12��Һ��Ӧ����CaCO3���� |
| D | ���Թ��н�ij�л�����������Һ����� | �������������� | ���л���һ����ȩ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | 6.0gSiO2�����д��ڵĹ��ۼ�����Ϊ2 NA | |
| B�� | 1L 0.1mol•L-1��Na2CO3��Һ�к��������ӵ�����Ϊ2NA | |
| C�� | ��״���£�2.0gD2O�к��е�����������������ΪNA�� | |
| D�� | ����ʱ��pH=12��Ba��OH��2��Һ�У�������������ĿΪ10-2N |
| A�� | ͬ����Ԫ����C���⻯���ȶ�����ǿ | |
| B�� | ͬ����Ԫ����A�Ľ�������ǿ | |
| C�� | ԭ�Ӱ뾶��A��B�����Ӱ뾶��A+��C- | |
| D�� | A��B��C�ļ������У����ƻ�ˮ�ĵ���ƽ�����C |
| A�� | Ԫ��A���γɵ��⻯�ﳣ����һ��Ϊ��̬ | |
| B�� | �ǽ����ԣ�A��E | |
| C�� | Ԫ��C��D��E����Ȼ���о�����������̬���� | |
| D�� | Ԫ��B���������Ӧ��ˮ����һ��Ϊǿ�� |
| Ŀ�� | ���� | |
| A | ����Cl2 | ������ͨ��ʢ�м�ʯ�ҵĸ���װ�� |
| B | �����������е���Ԫ�� | ȡ������NaOH��Һ�����ټ�AgNO3��Һ |
| C | �ⶨ����NaCl��Na2CO3������Ʒ��Na2CO3���������� | ȡm1g��Ʒ������������ַ�Ӧ���������ɺ�����������Ϊm2 g |
| D | ����100mL 1.0mol•L-1 CuSO4��Һ | ��25g CuSO4•5H2O����100mL����ˮ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | ij������Һ��pH=a��������Һϡ��10������Һ��pHֵΪb����b=a+1 | |
| B�� | CH3OOH��CH3COONa�����Һ�����ܴ��ڣ�c ��CH3COOH����c ��CH3COO-����c ��H+����c ��Na+����c ��0H-�� | |
| C�� | �����£���pH=3��H2SO4��pH=11��һԪ��BOH-��Һ�������ϣ�������Һ����Ϊ���Ի����� | |
| D�� | �����£�Ũ�Ⱦ�ΪO��1mol•L-1�Ģ�CH3COOH��Һ��NaOH��Һ��CH3OONa ��Һ�У�ˮ�ĵ���̶Ȣۣ��٣��� |