题目内容
1.工业上用电解饱和食盐水制取烧碱和氯气.用于电解的食盐水需要先除去其中的Ca2+、Mg2+、SO42-等离子.其除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,再加过量的Na2CO3和NaOH,充分反应后沉淀后将沉淀一并滤去.经过检测发现滤液中仍然含有一定量的SO42-,其原因是BaSO4和BaCO3的Ksp相差不大,当向溶液中加入大量CO32-时,一部分BaSO4(s)转化为BaCO3(s):BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),导致溶液含有一定量SO42-.[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9].分析 在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq).
解答 解:加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s),
故答案为:BaCl2;BaSO4和BaCO3的Ksp相差不大,当向溶液中加入大量CO32-时,一部分BaSO4(s)转化为BaCO3(s):BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),导致溶液含有一定量SO42-.
点评 本题考查了难溶物溶解平衡及其应用,题目难度中等,明确难溶物溶解平衡的影响因素为解答关键,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.以下指定反应的离子方程式正确的是( )
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
9.用电解法处理含有NH4+的废水,使之变为N2,其装置如图所示.下列说法不正确的是( )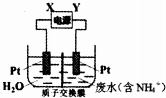

| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
16.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
6.下列实验装置图与对应的现象或结论的叙述均正确的是( )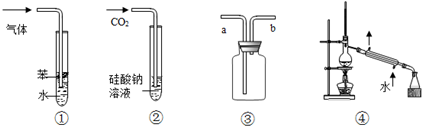

| A. | 装置①:可用于吸收NH3或HCl气体,并防止倒吸 | |
| B. | 装置②:持续通入CO2气体,先出现白色沉淀,后变澄清 | |
| C. | 装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3 | |
| D. | 装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物 |
13.短周期元素A、B、C的原子序数之和为37,A、B在同一周期,A+、C-具有相同的核外电子层结构.下列推测不正确的是( )
| A. | 同周期元素中C的氢化物稳定性最强 | |
| B. | 同周期元素中A的金属性最强 | |
| C. | 原子半径:A>B,离子半径:A+>C- | |
| D. | A、B、C的简单离子中,会破坏水的电离平衡的是C |

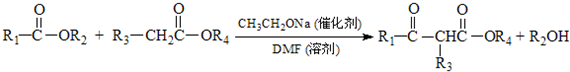
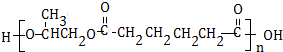 .
.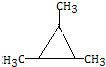 .
.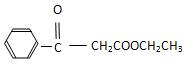
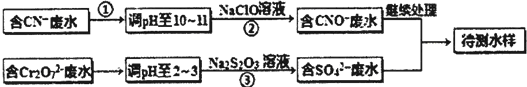
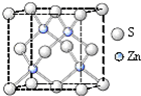 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答: