题目内容
1.0.1mol烷烃完全燃烧时生成11.2LCO2(标况),则其化学式是C5H12.若其一氯化物有四种同分异构体,则该烷烃的名称(系统命名法)是2-甲基-丁烷,结构简式是CH3CH2CH(CH3)CH3.分析 n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,由C原子守恒可知烷烃含C为$\frac{0.5mol}{0.1mol}$=5,为戊烷,一氯化物有四种同分异构体,则含4种H,以此来解答.
解答 解:n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,由C原子守恒可知烷烃含C为$\frac{0.5mol}{0.1mol}$=5,分子式为C5H12,为戊烷,戊烷同分异构体有:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4,符合一氯化物有四种同分异构体为CH3CH2CH(CH3)CH3,名称为2-甲基-丁烷,
故答案为:C5H12;2-甲基-丁烷;CH3CH2CH(CH3)CH3.
点评 本题考查有机物的分子式的确定,为高频考点,把握有机反应C原子守恒、同分异构体及结构为解答的关键,侧重分析与应用能力的考查,注意H原子判断,题目难度不大.

练习册系列答案
相关题目
6.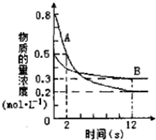 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )| A. | 前12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | 12s后,A的消耗速率等于B的生成速率 | |
| C. | 化学计量数之比b:c=1:2 | |
| D. | 12s内,A和B反应放出的热量为0.2Q kJ |
10.(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图图1违背能量最低原理、泡利原理,B元素位于周期表五个区域中的S区.
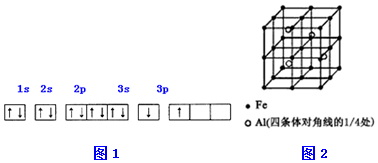
②ACl2分子中A的杂化类型为SP,ACl2的空间构型为直线.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式 .
.
③六氰合亚铁离子Fe(CN)64-中不存在B.A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为SP,ACl2的空间构型为直线.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式
 .
.③六氰合亚铁离子Fe(CN)64-中不存在B.A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
11.能证明碳酸酸性比硅酸酸性强的事实是( )
| A. | 碳酸能溶于水,硅酸不能 | |
| B. | CO2通入硅酸钠溶液后生成白色硅酸沉淀 | |
| C. | Na2CO3和SiO2高温反应生成Na2SiO3和CO2 | |
| D. | 盐酸和Na2CO3反应生成CO2,盐酸和Na2SiO3反应生成硅酸 |