题目内容
6.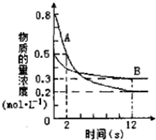 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )| A. | 前12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | 12s后,A的消耗速率等于B的生成速率 | |
| C. | 化学计量数之比b:c=1:2 | |
| D. | 12s内,A和B反应放出的热量为0.2Q kJ |
分析 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,
A.图象分析可知A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=$\frac{△c}{△t}$;
B.图象分析计算B的反应速率,浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,速率之比等于化学方程式计量数之比;
C.计算得到ABC的反应速率,速率之比等于化学方程式计量数之比;
D.12s内反应3molA放热QKJ,反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合化学方程式定量关系计算分析;
解答 解:某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,
A.图象分析可知A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=$\frac{△c}{△t}$=$\frac{0.6mol/L}{12s}$=0.05mol/(L•s),故A错误;
B.图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=$\frac{0.2mol/L}{12s}$=$\frac{1}{60}$,速率之比等于化学方程式计量数之比,3:b=0.05:$\frac{1}{60}$,b=1,3:c=0.05:$\frac{\frac{0.8mol}{2L}}{12s}$,c=2,化学方程式中AB计量数不同,12s后达到平衡状态,A的消耗速率不等于B的生成速率,故B错误;
C.图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=$\frac{0.2mol/L}{12s}$=$\frac{1}{60}$,速率之比等于化学方程式计量数之比,3:b=0.05:$\frac{1}{60}$,b=1,3:c=0.05:$\frac{\frac{0.8mol}{2L}}{12s}$,c=2,化学计量数之比b:c=1:2,故C正确;
D.12s内反应3molA放热QKJ,反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合化学方程式定量关系计算,3A(g)+B (g)?2C(g)△H=-Q kJ•mol-1,1.2molA反应放出热量0.4QKJ,故D错误;
故选C.
点评 本题考查了好像平衡的建立过程、化学反应速率的计算,注意化学反应速率之比等于化学方程式计量数之比,掌握基础是解题关键,题目难度中等.

 小学教材全测系列答案
小学教材全测系列答案(1)从下列仪器选出无需用到的仪器是(用标号字母填写)C,E,I.
(A) 电子天平 (B) 坩埚钳 (C) 试管夹 (D) 酒精灯 (E) 蒸发皿
(F) 玻璃棒 (G) 坩埚 (H) 干燥器 (I) 石棉网 (J) 三脚架 (K)泥三角
除上述仪器外,还需要的仪器是研钵、药匙.
(2)某学生实验后得到以下数据:
| 加热前质量 | 加热后质量 | |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 5.4g | 7.9g | 6.8g |
H2O%=44%,X=7.0,该生测定结果是偏高还是偏低?偏高.
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
(A) 加热过程中晶体有少量溅失;
(B) 加热前称量时容器未完全干燥;
(C) 最后两次加热后的质量相差较大(大于0.1克);
(D) 加热后容器未放入干燥器中冷却;
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作.
| A. | 取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,碱石灰增重bg | |
| B. | 取ag混合物与足量稀盐酸充分反应后,加热蒸干溶液,得bg固体 | |
| C. | 取ag混合物充分加热,得到bg固体 | |
| D. | 取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 常温下c(H+)为0.01 mol/L的盐酸由H2O电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| C. | 有关反应:(tBuNO)2??2(tBuNO),压强越大,反应物的转化率越大 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| A. | 它与水反应的离子方程式为NH4++H-+H2O=NH3•H2O+H2↑ | |
| B. | NH5中既有共价键又有离子键 | |
| C. | NH5的电子式为 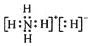 | |
| D. | 1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
| A. | 称量10.6 g Na2CO3溶于100 mL水中 | |
| B. | 称量10.6 g Na2CO3•10H2O溶于少量水中,再用水稀释至100 mL | |
| C. | 量取20 mL 5.0 mol/L Na2CO3溶液用水稀释至100 mL | |
| D. | 配制80 mL 1.0 mol/L Na2CO3溶液,则只需要称量8.5 g Na2CO3 |
