题目内容
20.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )| A. | 将 SO2 通入水中 | B. | 将 HCl 通入水中 | C. | 烧碱溶于水 | D. | 硫酸氢钾溶于水 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,电解质溶于水电离时破坏化学键,据此分析解答.
解答 解:A.二氧化硫和水反应生成亚硫酸,亚硫酸电离生成氢离子和亚硫酸氢根离子,二氧化硫、亚硫酸中都只含共价键,二氧化硫和水反应生成亚硫酸有共价键的破坏和形成,亚硫酸电离有共价键的破坏,故A不选;
B.HCl在水分子的作用下电离出阴阳离子,HCl中只含共价键,所以只有共价键的破坏,故B不选;
C.NaOH溶于水电离生成钠离子和氢氧根离子,所以只破坏离子键,故C不选;
D.硫酸氢钾溶于水电离生成钾离子、氢离子和硫酸根离子,有离子键和共价键的破坏,故D选;
故选D.
点评 本题考查化学键,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,注意:硫酸氢钾在水溶液中电离生成氢离子、钾离子和硫酸根离子,而熔融状态下电离生成钾离子和硫酸氢根离子,题目难度不大.

练习册系列答案
相关题目
11.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是A-+H2O?HA+OH-.(用反应的离子方程式表示),
(2)②组情况表明,c>0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)=c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度>NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(2)②组情况表明,c>0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)=c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度>NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
8.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)正确表示元素②在周期表中的位置第二周期第ⅣA族
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物对应的水化物是两性氢氧化物的元素是Al(填元素符号),写出它的氧化物与⑤的氢氧化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)⑧的单质有许多重要用途,写出其工业生产反应的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是(用离子符号表示)O2-、Na+、Mg2+.
| 列 周期 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物对应的水化物是两性氢氧化物的元素是Al(填元素符号),写出它的氧化物与⑤的氢氧化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)⑧的单质有许多重要用途,写出其工业生产反应的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是(用离子符号表示)O2-、Na+、Mg2+.
15.下列实验现象与对应化学(或离子)方程式都正确的是( )
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═Na++OH-+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
5.下列说法中正确的是( )
| A. | 1mol H2的质量只有在标准状况下才约为2g | |
| B. | 标准状况下,22.4L氖气含有的原子数为2NA | |
| C. | 标准状况下,18g水的体积约为22.4L | |
| D. | 同温同压下,相同体积的气体单质含有的原子数目不一定相等 |
10.下列实验装置图正确的是( )
| A. |  制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  石蜡油的催化裂化 |
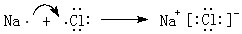 .
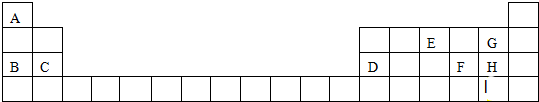
. A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题: