题目内容
9.设NA代表阿伏加德罗常数,下列说法中正确的是( )| A. | 100mL1mol/L的碳酸钠溶液中含有CO32-为1NA | |
| B. | 常温、常压下,0.5mol臭氧中含有氧原子为1.5NA | |
| C. | 标准状况下,1mol NO2气体与水反应生成NO3-为NA | |
| D. | 78gNa2O2中含有O2-为2NA |
分析 A、碳酸根为弱酸根,在溶液中会水解;
B、臭氧为三原子分子;
C、NO2与水的反应为:3NO2+H2O=2HNO3+NO;
D、过氧化钠中含有的是O22-,不含O2-.
解答 解:A、碳酸根为弱酸根,在溶液中会水解,故溶液中的碳酸根的个数小于NA个,故A错误;
B、臭氧为三原子分子,故0.5mol臭氧中含1.5mol氧原子即1.5NA个,故B正确;
C、NO2与水的反应为:3NO2+H2O=2HNO3+NO,故1mol二氧化氮反应生成$\frac{2}{3}$mol硝酸,即$\frac{2}{3}$NA个硝酸根,故C错误;
D、过氧化钠中含有的是O22-,不含O2-,故过氧化钠中不含O2-,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA | |
| D. | 在反应KI03+6HI=KI+3I2+3H20中,每生成3 mol I2转移的电子数为6 NA |
4.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe2++4OH-.说法正确的是( )
| A. | 负极发生的反应为:Fe-3e-═Fe3+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 钢柱在水下部分比在空气与水交界处更难腐蚀 |
18.下列离子方程式正确的是( )
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2 NO↑+4H2O |
19.甲烷和氯气的混合气体在光照条件下发生反应,生成氯化氢、一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷.下列有关说法正确的是( )
| A. | 该反应既是取代反应又是置换反应 | |
| B. | 一氯甲烷的电子式是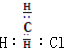 | |
| C. | 二氯甲烷分子有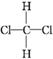 和 和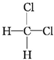 两种空间结构 两种空间结构 | |
| D. | 三氯甲烷和四氯甲烷是工业上重要的溶剂 |
 如图转化关系中,A、B、C为单质,其余方框内均为化合物,B、X、N常温下为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中均含同一种元素(框图中某些生成物已略去).请填写下列空白:
如图转化关系中,A、B、C为单质,其余方框内均为化合物,B、X、N常温下为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中均含同一种元素(框图中某些生成物已略去).请填写下列空白: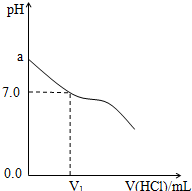 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的Ph值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的Ph值的变化关系如图所示.