题目内容
18.下列离子方程式正确的是( )| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2 NO↑+4H2O |
分析 A.一水合氨在离子反应中保留化学式;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.反应生成硫酸根离子;
D.遵循电子、电荷守恒.
解答 解:A.向盐酸中滴加氨水的离子反应为H++NH3•H2O-═H2O+NH4+,故A错误;
B.Fe(OH)3溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.向Na2S2O3溶液中通入足量氯气的离子反应为6OH-+S2O32-+4Cl2═2SO42-+8Cl-+3H2O,故C错误;
D.铜溶于稀硝酸的离子反应为3Cu+8H++2NO3-═3Cu2++2 NO↑+4H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
8.某温度下将Cl2通入KOH溶液里,反应后得到KCI、KC1O、KC1O3的混合溶液,经测定ClO- 与ClO3-的物质的量浓度之比为11:1,则C12与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:4 |
9.设NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 100mL1mol/L的碳酸钠溶液中含有CO32-为1NA | |
| B. | 常温、常压下,0.5mol臭氧中含有氧原子为1.5NA | |
| C. | 标准状况下,1mol NO2气体与水反应生成NO3-为NA | |
| D. | 78gNa2O2中含有O2-为2NA |
13.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 苏打--NaHCO3 | B. | 胆矾--ZnSO4 | C. | 酒精--C2H5OH | D. | 生石灰--Ca(OH)2 |
3.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 家用燃气灶是化学能转化为热能的应用装置 | |
| B. | 食品放入冰箱中,因为温度低,变质速率降低,所以食品能够保存较长时间 | |
| C. | 将煤气化,有利于提供更多的能量,而且有效地减少温室气体的产生 | |
| D. | 因为食用醋中含有酸,可以用来清洗锅垢 |
10.将SO2气体通入BaCl2溶液,若要有白色沉淀产生,不可加入(通入)的试剂是( )
| A. | 硝酸溶液 | B. | 二氧化碳 | C. | 氢氧化钠溶液 | D. | 氨水 |
7.下列离子反应方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 将金属Na加入冷水中:2 Na+2 H2O═2 Na++2 OH-+H2↑ | |
| C. | 盐酸滴入澄清石灰水:Ca(OH)2+2 H+═Ca2++2 H2O | |
| D. | 澄清石灰水吸收氯气:Cl2+OH-═Cl-+ClO-+H+ |
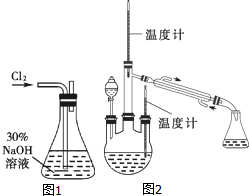 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl