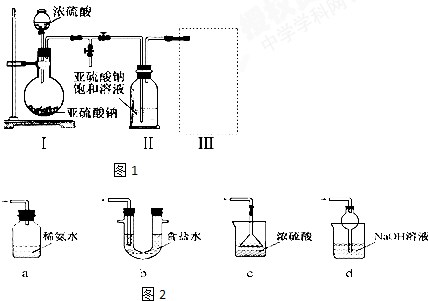
题目内容
19.如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.戊为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,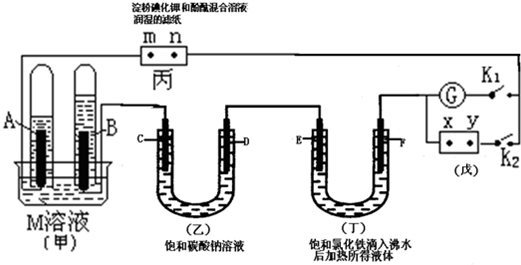
(1)足量的M溶液可能是CE(填序号).
A.AgNO3溶液 B.CuCl2溶液 C.H2SO4溶液 D.CuSO4溶液 E.Na2SO4溶液
(2)X是正极(填正极或负极)
(3)m极电极反应方程式2I--2e-=I2
(4)Na2CO3溶液中加酚酞呈红色,原因CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-(用离子方程式表示)某同学认为在D极会有两种气体产生,写出反应过程中的离子方程式:O2和CO2
(5)丁中E(填“E”或“F”)极颜色加深.
(6)若M溶液为KOH溶液,继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,各电解池均将恢复原状;B极反应方程式O2+4e-+2H2O=4OH-.
分析 闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,甲中A、B两极应分别生成氢气、氧气,则A为阴极,B为阳极,依次可知d、f、m为阳极,c、e、n为阴极,X为正极、Y为负极,
(1)A、B两极产生的气体体积之比为2:1,则A极是氢气产生,B电极上产生氧气,所以电解质M是电解水型的电解质;
(2)A极是氢气产生,B电极上产生氧气,所以Y是负极,X是正极;
(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色;
(4)Na2CO3为强碱弱酸盐,水解呈碱性,D电极是阳极,在该极上放电的是氢氧根离子,会产生大量的氧气,同时会产生少量的二氧化碳气体;
(5)饱和的氯化铁加入沸水中会生成氢氧化铁红褐色沉淀,氢氧化铁胶粒带有正电;
(6)形成燃料电池,B为正极.
解答 解:闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,甲中A、B两极应分别生成氢气、氧气,则A为阴极,B为阳极,依次可知d、f、m为阳极,c、e、n为阴极,X为正极、Y为负极,
(1)闭合K2、断开K1,一段时间后,形成串联电解电路,A、B两极产生的气体体积之比为2:1,则A极是氢气产生,B电极上产生氧气,所以电解质M是电解水型的电解质,CE符合,
故答案为:CE;
(2)闭合K2、断开K1,形成串联电解电路,则A极是氢气产生,B电极上产生氧气,所以Y是负极,X是正极,故答案为:正极;
(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,电极方程式为2I--2e-=I2,故答案为:2I--2e-=I2;
(4)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,D电极是阳极,在该极上放电的是氢氧根离子,会产生大量的氧气,同时会产生少量的二氧化碳气体,
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;O2和CO2;
(5)在丁装置中,饱和的氯化铁加入沸水中会生成氢氧化铁红褐色沉淀,再外加电源作用下,会发生电泳,氢氧化铁胶粒带有正电,所以移向阴极,即移向E即,
故答案为:E;
(6)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
点评 本题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题,题目有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,注意根据电解现象判断阴阳极和正负极.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案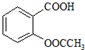 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1: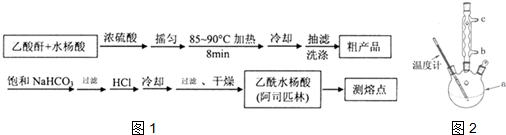
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解;
(2)写出制备阿司匹林的化学方程式
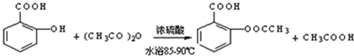 ;
;(3)①合成阿斯匹林时,最合适的加热方法是水浴加热;
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次;
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离;
另一种改进的提纯方法,称为重结晶提纯法.方法如下:
[粗产品]$→_{沸石}^{乙酸乙酯}$ $→_{回流}^{加热}$ $\stackrel{趁热过滤}{→}$ $→_{抽滤}^{冷却}$ $→_{干燥}^{洗涤}$[乙酰水杨酸]
(5)改进的提纯方法中加热回流的装置如2图所示,使用温度计的目的是控制反应温度,防止温度过高,避免乙酰水杨酸受热分解;冷凝水的流进方向是b(填“b”或“c”)
(6)检验产品中是否含有水杨酸的试剂是FeCl3溶液;
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
| A. | H2→H2O | B. | Fe2O3→Fe2+ | C. | HCl→FeCl2 | D. | Na→NaOH |
| A. | H+、Na+、HCO3-、Cl- | B. | Fe3+、SCN-、Cl-、NO3- | ||
| C. | Mg2+、Cu2+、SO42-、NO3- | D. | Fe2+、SO42-、H+、NO3- |
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$;△H=-226kJ/mol
根据以上热化学方程式判断,下列说法不正确的是( )
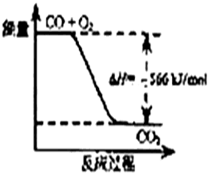
| A. | CO的燃烧热为283 kJ/mol | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
| A. | 食盐可作调味剂,也可用作食品防腐剂 | |
| B. | 二氧化硫可用于制作葡萄酒的食品添加剂 | |
| C. | 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂 | |
| D. | “地沟油”禁止食用,但可用来制取肥皂 |
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:4 |
| A. | 100mL1mol/L的碳酸钠溶液中含有CO32-为1NA | |
| B. | 常温、常压下,0.5mol臭氧中含有氧原子为1.5NA | |
| C. | 标准状况下,1mol NO2气体与水反应生成NO3-为NA | |
| D. | 78gNa2O2中含有O2-为2NA |