题目内容
11.下列各物质中,不能发生水解反应的是( )| A. | 油脂 | B. | 果糖 | C. | 氨基酸 | D. | 淀粉 |
分析 多糖、二糖、油脂、蛋白质、酯类、卤代烃等有机物在一定条件下可发生水解反应,以此来解答.
解答 解:A.油脂可水解生成高级脂肪酸(或盐)和甘油,故A不选;
B.果糖为单糖,不能水解,故B选;
C.氨基酸含氨基、羧基,不能发生水解反应,故C选;
D.淀粉为多糖,可水解生成葡萄糖,故D不选;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成和类别、有机反应为解答的关键,侧重分析与应用能力的考查,注意官能团与性质的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-═Fe2S3 | |
| C. | 过量的铁与稀硝酸溶液:3Fe+8H++2NO3-═3Fe2++4H2O+2NO? | |
| D. | 铁粉放入氯化铁溶液:Fe+Fe3+═Fe2+ |
2.下列说法错误的是( )
| A. | 燃烧氧化法可以对有机物进行定性与定量的元素分析 | |
| B. | 提纯液体混合物常用重结晶法 | |
| C. | 红外光谱与核磁共振氢谱可以用于确定有机物的官能团和结构式 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
19.下列反应起了氮的固定作用是( )
| A. | N2和H2在一定条件下反应生成NH3 | |
| B. | NH3经过一系列反应之后生成硝酸盐 | |
| C. | NO与O2反应生成NO2 | |
| D. | 氯化铵受热分解 |
6.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )
| A. | 1 mol甲苯与3 mol H2发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色生成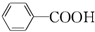 | |
| C. | 甲苯燃烧产生带浓烟的火焰 | |
| D. | 甲苯与浓硝酸反应生成三硝基甲苯 |
16.下列物质一定属于同系物的是( )
① ②
② ③
③ ④C2H4
④C2H4
⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
①
 ②
② ③
③ ④C2H4
④C2H4⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ④和⑧ | D. | ⑦和⑧ |
3.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1).下列有关元素X的说法中正确的是( )
| A. | X可能是金属元素 | |
| B. | 由X形成的含氧酸均为强酸 | |
| C. | X不能形成化学式为KXO4的含氧酸盐 | |
| D. | 元素X的气态氢化物一定极易溶于水 |
20.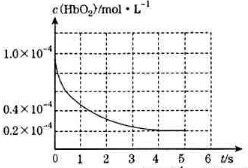 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 反应开始至4s内用HbO2表示的平均反应速率为2×10-4mol/(L•s) | |
| B. | 反应达平衡之前,O2与HbO2的反应速率逐渐减小 | |
| C. | 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 | |
| D. | 该温度下反应CO+HbO2?O2+HbCO的平衡常数为107 |
10. 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是: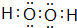 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
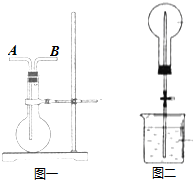
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是:
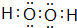 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.