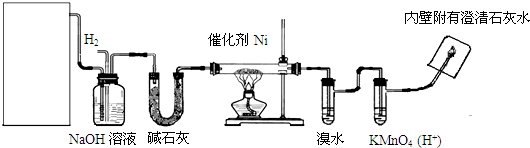
题目内容
6.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )| A. | 1 mol甲苯与3 mol H2发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色生成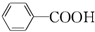 | |
| C. | 甲苯燃烧产生带浓烟的火焰 | |
| D. | 甲苯与浓硝酸反应生成三硝基甲苯 |
分析 侧链对苯环有影响,使苯环变得活泼,更容易发生取代反应,所以甲苯硝化时能生成三硝基甲苯.
解答 解:A、1mol甲苯或1mol苯都能与3molH2发生加成反应,所以不能说明侧链对苯环有影响,故A错误;
B、烷烃中的甲基不能被高锰酸钾溶液氧化,而甲苯中的甲基可以被高锰酸钾氧化为苯甲酸,这说明苯环使侧链活化,而不能体现侧链对苯环的影响,故B错误;
C、苯和甲苯都能燃烧产生带浓烟的火焰,这是由于碳的百分含量较高、碳不完全燃烧导致,所以不能说明侧链对苯环有影响,故C错误;
D、甲苯和苯都能与浓硝酸、浓硫酸发生取代反应,但产物不同,侧链对苯环有影响,使苯环变得活泼,更容易发生取代反应,甲苯硝化生成三硝基甲苯,能说明侧链对苯环有影响,故D正确.
故选D.
点评 本题以侧链对苯环的影响为载体考查了苯的同系物的化学性质,难度不大,注意:苯环对甲基的影响导致甲苯能被酸性高锰酸钾氧化成甲酸,而同时苯环对侧链也有影响甲苯能使酸性高锰酸钾褪色.

练习册系列答案
相关题目
16.下列关于苯的叙述中正确的是( )
| A. | 苯分子中碳碳键为单双键交替结构 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯与氢气在一定条件下反应生成环己烷 | |
| D. | 苯可以与溴水反应而使其褪色 |
17.对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是( )
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.5 mol/(L•s) | C. | v(C)=0.9 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
14.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 金刚石 | C. | 干冰 | D. | 二氧化硅 |
1.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 酸性氧化物 干冰 SO2 | B. | 碱 苛性钠 NaOH | ||
| C. | 盐 钡餐 BaCO3 | D. | 单质 氯水 Cl2 |
11.下列各物质中,不能发生水解反应的是( )
| A. | 油脂 | B. | 果糖 | C. | 氨基酸 | D. | 淀粉 |
15.含苯酚的工业废水处理的流程图细下图所示,下列说法不确的是( )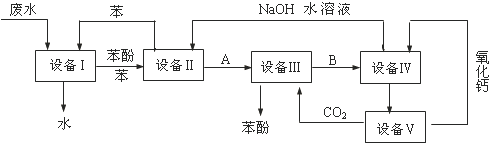

| A. | 上述流程里,设备Ⅰ、Ⅱ中进行的是分液操作;实验室里该操作可以用分液漏斗进行 | |
| B. | 上述流程里,设备Ⅲ、Ⅳ中进行的是过滤操作;实验室里该操作用到的玻璃仪器有:漏斗、烧杯、玻璃棒 | |
| C. | 在设备Ⅲ中发生反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3 | |
| D. | 图中循环使用的物质是C6H6、CaO、CO2和NaOH |
5.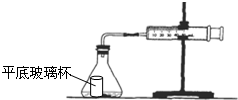 盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
(1)检查装置的性能:组装好如图所示的装置后,用双手握住锥形瓶.观察现象.如果玻璃注射器中的活塞比较均匀地向外滑行,说明该装置的性能好,可用.
(2)在图中的锥形瓶中加入5g大理石,在平底玻璃杯中加入20mL1mol•L-1盐酸,并小心放于锥形瓶底,塞好带导管的塞子,玻璃注射器中的活塞归0.倾斜锥形瓶,使平底玻璃杯中的盐酸全部流到锥形瓶底部.每隔10s观测玻璃注射器中气体的体积,并填入表中:
(3)以mL•s-1为反应速率的单位,计算每10s时间间隔内的反应速率,将计算结果填入第23题表中:
(4)从第23题表中反应速率随时间变化的数据得到的结论是:本实验中反应速率随时间推移,先小后大最后又变小.
(5)以上结论的原因是:开始时,虽然盐酸浓度较大,但温度较低,反应速率较小;后来一段时间内,主要是碳酸钙跟盐酸反应放出热量,体系温度升高,速率较大;最后盐酸浓度明显减小,反应速率小,单位时间放出的热量少,加上散热使温度降低,速率变小.
 盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:(1)检查装置的性能:组装好如图所示的装置后,用双手握住锥形瓶.观察现象.如果玻璃注射器中的活塞比较均匀地向外滑行,说明该装置的性能好,可用.
(2)在图中的锥形瓶中加入5g大理石,在平底玻璃杯中加入20mL1mol•L-1盐酸,并小心放于锥形瓶底,塞好带导管的塞子,玻璃注射器中的活塞归0.倾斜锥形瓶,使平底玻璃杯中的盐酸全部流到锥形瓶底部.每隔10s观测玻璃注射器中气体的体积,并填入表中:
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/mL•s-1 | 0.4 | 1.0 | 1.1 | 1.3 | 0.9 | 0.8 |
(4)从第23题表中反应速率随时间变化的数据得到的结论是:本实验中反应速率随时间推移,先小后大最后又变小.
(5)以上结论的原因是:开始时,虽然盐酸浓度较大,但温度较低,反应速率较小;后来一段时间内,主要是碳酸钙跟盐酸反应放出热量,体系温度升高,速率较大;最后盐酸浓度明显减小,反应速率小,单位时间放出的热量少,加上散热使温度降低,速率变小.