题目内容
19.下列反应起了氮的固定作用是( )| A. | N2和H2在一定条件下反应生成NH3 | |
| B. | NH3经过一系列反应之后生成硝酸盐 | |
| C. | NO与O2反应生成NO2 | |
| D. | 氯化铵受热分解 |
分析 氮的固定是指将游离态的氮元素转化为化合态的氮元素的过程,即将氮气转化为含氮化合物.
解答 解:A、N2与H2在一定条件下反应生成NH3的过程,是将游离态的氮元素转化为化合态的氮元素的过程,属于氮的固定,故A正确;
B、由氨气制碳铵和硫铵等硝酸盐是含氮化合物之间的转化,不属于氮的固定,故B错误;
C、NO与O2反应生成NO2是含氮化合物之间的转化,不属于氮的固定,故C错误;
D、氯化铵受热分解生成氨气和氯化氢气体,不是氮的固定,故D错误;
故选A.
点评 本题是对氮的固定的概念的考查,要求学生熟记教材知识,注意分析化学反应同种,题目难度不大.

练习册系列答案
相关题目
9.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
14.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 金刚石 | C. | 干冰 | D. | 二氧化硅 |
11.下列各物质中,不能发生水解反应的是( )
| A. | 油脂 | B. | 果糖 | C. | 氨基酸 | D. | 淀粉 |
8.如图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是( )
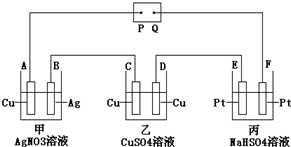

| A. | P是电源的正极 | |
| B. | F极上发生的反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 | |
| D. | 通电后,甲池溶液的pH减小,乙池溶液的浓度增大、丙池溶液的pH不变 |
9.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1.5mol单质Fe粉在足量氧气中完全燃烧,失去4NA个电子 | |
| B. | 在25g质量分数为60%的乙酸水溶液中,含有氢原子数为NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中,含有的阴离子数等于0.15NA | |
| D. | 在5×107Pa、500°C和铁触媒作用下,1molN2和3molH2可生成氨气分子数为2NA |
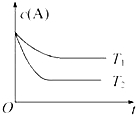 反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol•L-1.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:
反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol•L-1.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题: