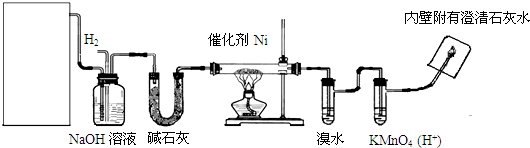
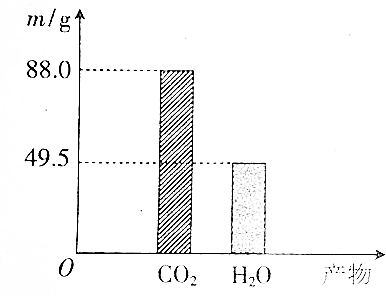
题目内容
3.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1).下列有关元素X的说法中正确的是( )| A. | X可能是金属元素 | |
| B. | 由X形成的含氧酸均为强酸 | |
| C. | X不能形成化学式为KXO4的含氧酸盐 | |
| D. | 元素X的气态氢化物一定极易溶于水 |
分析 根据原子核外最外层电子数不超过8可知,2n-1≤8,则n≤4.5,根据n为正整数可分别取值1、2、3、4进行讨论判断,结合元素的性质进行分析.
解答 解:原子核外最外层电子数不超过8可知,2n-1≤8,则n≤4.5,
讨论:n=1,电子层数为1-1=0,不符合题意;
n=2,电子层数为2-1=1,最外层电子数为2×2-1=3,不存在;
n=3时,电子层数为3-1=2,最外层电子数为2×3-1=5,为N元素;
n=4时,电子层数为4-1=3,最外层电子数为2×4-1=7,为Cl元素.
A.X为N或Cl,为非金属元素,故A错误;
B.由X形成的含氧酸不一定是强酸,如HClO为弱酸,故B错误;
C.元素X的最高价氧化物的水化物为硝酸或高氯酸,高氯钾的化学式为KXO4,故C错误;
D.元素X的气态氢化物为氨气或氯化氢,都极易溶于水,故D正确.
故选D.
点评 本题考查原子结构和元素周期律的关系,题目难度中等,注意结合电子层数和最外层电子数进行讨论解答,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
13.下列各物质中既能发生消去反应,又能被氧化为醛的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
14.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 金刚石 | C. | 干冰 | D. | 二氧化硅 |
11.下列各物质中,不能发生水解反应的是( )
| A. | 油脂 | B. | 果糖 | C. | 氨基酸 | D. | 淀粉 |
8.如图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是( )
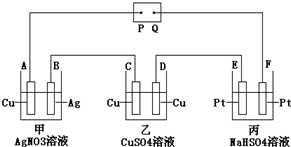

| A. | P是电源的正极 | |
| B. | F极上发生的反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 | |
| D. | 通电后,甲池溶液的pH减小,乙池溶液的浓度增大、丙池溶液的pH不变 |
15.含苯酚的工业废水处理的流程图细下图所示,下列说法不确的是( )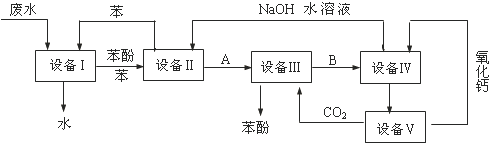

| A. | 上述流程里,设备Ⅰ、Ⅱ中进行的是分液操作;实验室里该操作可以用分液漏斗进行 | |
| B. | 上述流程里,设备Ⅲ、Ⅳ中进行的是过滤操作;实验室里该操作用到的玻璃仪器有:漏斗、烧杯、玻璃棒 | |
| C. | 在设备Ⅲ中发生反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3 | |
| D. | 图中循环使用的物质是C6H6、CaO、CO2和NaOH |
2.判断下列元素中不属于主族元素的是( )
| A. | 铁 | B. | 钠 | C. | 磷 | D. | 氯 |