题目内容
(研究性学习小组对某硫酸亚铁晶体(FeSO4?xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值.
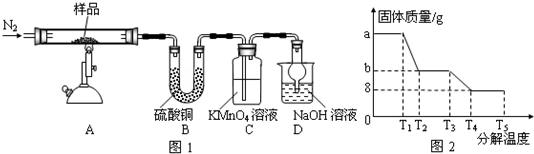
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 .
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”).
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3.
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 .
(5)装置D球形干燥管的作用 .
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x= .

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有
(2)实验中要持续通入氮气,否则测出的x会
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3.
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式
(5)装置D球形干燥管的作用
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x=
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)二氧化硫能使高锰酸钾溶液褪色;
(2)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,配平即可;
(5)装置D主要是吸收产生的过多二氧化硫气体防止污染空气,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸;
(6)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,根据原子守恒计算;
(2)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,配平即可;
(5)装置D主要是吸收产生的过多二氧化硫气体防止污染空气,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸;
(6)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,根据原子守恒计算;
解答:
解:(1)二氧化硫能使高锰酸钾溶液褪色,故答案为:二氧化硫;
(2)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,故答案为:偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,方程式为2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4
Fe2O3+SO2↑+SO3↑;
(5)装置D氢氧化钠溶液主要是吸收产生的过多二氧化硫气体防止污染空气,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸,故答案为:防止氢氧化钠溶液倒吸;
(6)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
故答案为:7.
(2)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,故答案为:偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,方程式为2FeSO4
| ||
| ||
(5)装置D氢氧化钠溶液主要是吸收产生的过多二氧化硫气体防止污染空气,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸,故答案为:防止氢氧化钠溶液倒吸;
(6)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
故答案为:7.
点评:本题主要考查了学生根据实验原理从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,难度较大.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、醋酸钠溶液中滴加酚酞显红色,证明醋酸为弱电解质 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| D、某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,则该温度下pH=1的盐酸中水电离的c(H+)=1.0×10-12mol/L |
解释下列现象的化学用语不正确的是( )
| A、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+1AlO2-+2H2O |
| B、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3?H2O |
| C、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
闪电时空气中的N2和O2会发生反应:N2(g)+2O2(g)═2NO2(g)△H=+180.50kJ/mol,△S=247.3J/(mol?K),若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
| A、在1 000℃时,此反应能自发进行 |
| B、在1 000℃时,此反应不能自发进行 |
| C、该反应能自发进行的最低温度约为730℃ |
| D、该反应能自发进行的最高温度约为730 K |
 回答下列各题:
回答下列各题: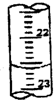 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下: ;
; +RCl→NaCl+
+RCl→NaCl+
