题目内容
下列叙述中不正确的是( )
| A、向氯化钙溶液中通入少量CO2,有白色沉淀CaCO3生成 |
| B、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| C、向NaAlO2溶液中通入过量CO2,有白色胶状沉淀析出 |
| D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下生成CO2体积比为53:42 |
考点:钠的重要化合物,镁、铝的重要化合物
专题:元素及其化合物
分析:A.碳酸的酸性弱于盐酸;
B.依据碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸氢钠溶解度小于碳酸钠解答;
C.NaAlO2溶液中通入过量CO2,反应生成氢氧化铝和碳酸氢钠;
D.依据方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑解答.
B.依据碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸氢钠溶解度小于碳酸钠解答;
C.NaAlO2溶液中通入过量CO2,反应生成氢氧化铝和碳酸氢钠;
D.依据方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑解答.
解答:
解:A.碳酸的酸性弱于盐酸,依据强酸制弱酸的规律,向氯化钙溶液中通入少量CO2,不会发生反应,故A错误;
B.碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸氢钠溶解度小于碳酸钠,所以会有晶体析出,故B正确;
C.NaAlO2溶液中通入过量CO2,反应生成氢氧化铝,氢氧化铝为白色胶状沉淀,故C正确;
D.取mg碳酸钠和mg碳酸氢钠足量盐酸反应,依据方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 1
m
NaHCO3+HCl=NaCl+H2O+CO2↑
84 1
m
依据阿伏伽德罗定律,在同温同压下生成CO2体积比等于物质的量之比=
:
=53:42,故D正确;
故选:A.
B.碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸氢钠溶解度小于碳酸钠,所以会有晶体析出,故B正确;
C.NaAlO2溶液中通入过量CO2,反应生成氢氧化铝,氢氧化铝为白色胶状沉淀,故C正确;
D.取mg碳酸钠和mg碳酸氢钠足量盐酸反应,依据方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 1
m
| m |
| 106 |
NaHCO3+HCl=NaCl+H2O+CO2↑
84 1
m
| m |
| 84 |
依据阿伏伽德罗定律,在同温同压下生成CO2体积比等于物质的量之比=
| m |
| 84 |
| m |
| 106 |
故选:A.
点评:本题考查了物质的性质,题目难度不大,熟悉物质的性质是解题关键,侧重对学生基础知识的巩固和训练,注意碳酸钠和碳酸氢钠性质的比较.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
在其它条件不变时,10℃时以某物质表示的反应速率为3mol/(L?s),已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为( )
| A、48 mol/(L?s) |
| B、36mol/(L?s) |
| C、24 mol/(L?s) |
| D、12 mol/(L?s) |
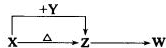
T℃时在2L密闭容器中使x(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示.则下列结论正确的是( )

| A、容器中发生的反应可表示为:4X(g)+Y(g)═2Z(g) |
| B、反应进行的前3min内,用x表示的反应速率V(X)=0.3mol/(L?min) |
| C、升高温度,反应的化学平衡常数K增大 |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中溶液的描述正确的是( )
| A、溶液的体积10V甲≥V乙 |
| B、水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D、若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
下列各组离子能在酸性的无色溶液中大量共存的是( )
| A、K+、Cl-、HCO3-、SO42- |
| B、Mg2+、Cl-、Al3+、SO42- |
| C、Ca2+、Fe3+、Na+、NO3- |
| D、Ba2+、Cl-、Na+、CO32- |
已知反应:
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
| A、FeCl3>I2>Cl2>H2SO4 |
| B、FeCl2>FeCl3>Cl2>I2 |
| C、Cl2>FeCl3>I2>H2SO4 |
| D、Cl2>H2SO4>I2>FeCl3 |
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )
| A、次磷酸的电离方程式为H3PO2?3H++PO23- |
| B、次磷酸中P的化合价为+1 |
| C、NaH2PO2是酸式盐 |
| D、NaH2PO2溶液显弱酸性 |
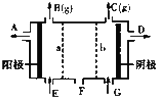 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |