题目内容
对于实验的描述正确的是( )
A、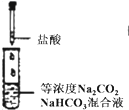 逐滴滴加稀盐酸时,试管中立即产生大量气泡 |
B、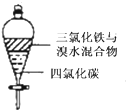 充分振荡后静置,下层溶液为橙红色,上层无色 |
C、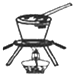 从饱和食盐水中提取NaCl晶体 |
D、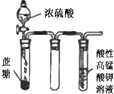 酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.盐酸先与碳酸钠反应;
B.氯化铁是黄色溶液;
C.蒸发用蒸发皿;
D.浓硫酸具有脱水性,生成C,然后发生氧化还原反应生成二氧化硫.
B.氯化铁是黄色溶液;
C.蒸发用蒸发皿;
D.浓硫酸具有脱水性,生成C,然后发生氧化还原反应生成二氧化硫.
解答:
解:A.盐酸先与碳酸钠反应生成碳酸氢钠,没有气泡,故A错误;
B.氯化铁是黄色溶液,上层呈黄色,故B错误;
C.蒸发溶液用蒸发皿,灼烧固体用坩埚,故C错误;
D.浓硫酸具有脱水性,生成C,然后发生氧化还原反应生成二氧化硫,最后与高锰酸钾发生氧化还原反应而使溶液褪色,故D正确.
故选D.
B.氯化铁是黄色溶液,上层呈黄色,故B错误;
C.蒸发溶液用蒸发皿,灼烧固体用坩埚,故C错误;
D.浓硫酸具有脱水性,生成C,然后发生氧化还原反应生成二氧化硫,最后与高锰酸钾发生氧化还原反应而使溶液褪色,故D正确.
故选D.
点评:本题考查化学实验方案的评价,涉及物质的性质、萃取、蒸发以及氧化还原反应等,A为解答的难点,注意发生的化学反应,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关说法中,错误的是( )
| A、若NA表示阿伏加德罗常数的值,则标准状况下11.2 L H2所含氢原子数为NA |
| B、1 L 1 mol?L-1的氯化钙溶液中,Cl-的浓度为2 mol/L |
| C、硫酸的摩尔质量为98g |
| D、从 1 mol?L-1的NaCl溶液中倒出5 mL溶液,Na+的浓度为1 mol?L-1 |
人工合成化合物NH5 可改写成NH4H,能和水反应:NH5+H2O═NH3H2O+H2↑.下列说法正确的是( )
| A、NH5属于离子化合物,该反应中水做氧化剂 |
| B、该反应属于氧化还原反应,NH5既是氧化剂又是还原剂 |
| C、该反应不属于氧化还原反应,属于复分解反应 |
| D、标准状况下每生成22.4LH2时,转移2NA电子 |
下列事实能用勒夏特列原理解释的是( )
| A、H2、I2、HI平衡混合气体加压后颜色变深 |
| B、使用催化剂,提高合成氨的产率 |
| C、高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D、新制的氯水在光照条件下颜色变浅 |
已知反应:
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
| A、FeCl3>I2>Cl2>H2SO4 |
| B、FeCl2>FeCl3>Cl2>I2 |
| C、Cl2>FeCl3>I2>H2SO4 |
| D、Cl2>H2SO4>I2>FeCl3 |
有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质.下列各项的事实不能说明上述观点的是( )
| A、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾褪色 |
| B、乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 |
| C、苯酚与溴水可直接反应,而苯与液溴反应则需要铁作催化剂 |
| D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
金属铜与人体分泌物中的盐酸以及体内的空气反应可生成超氧酸:Cu+HCl+O2=CuCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是( )
| A、氧化剂是O2 |
| B、HO2在碱中不能稳定存在 |
| C、氧化产物是HO2 |
| D、1mol Cu参加反应有1mol电子发生转移 |
